Глаукомой и дегенеративными процессами можно управлять, корректируя работу ганглиев сетчатки на генном уровне
Впервые «омоложением» клеток сетчатки прервана возрастная потеря зрения, вызванная глаукомой, а не просто остановлено ее прогрессирование
К сведениям об оптогенетике, размещенным на нашем сайте в прошлых выпусках, добавим, что, в свете последних научных данных, генная терапия способна обеспечить защиту нейронных сетей глаза и предотвратить ущерб зрению из-за глаукомы.
На портале крупнейшего профильного информационно-образовательного ресурса Glaucoma Research Foundation (GRF), в новостном разделе размещены сообщения экспертов-обозревателей о приоритете научного направления оптогенетики в уходящем году и в перспективе.
В частности, здесь представлен исследовательский проект, финансируемый системой Национального здравоохранения США (NIH), по разработке принципиально новых методов терапии, сохраняющей зрение у людей с диагностированной глаукомой. Модельные опыты на грызунах показали, что генная терапия может стать мощным нейропротекторным средством работы с глаукомным поражением зрения.

О пионерном проекте рассказал в журнале Cell (“Клетка») ведущий исследователь Бо Чен, доцент офтальмологии и нейробиологии в Медицинской школе Икана на горе Синай в Нью-Йорке (ASSOCIATE PROFESSOR | Ophthalmology; ASSOCIATE PROFESSOR | Neuroscience ; ASSOCIATE PROFESSOR | Cell, Developmental & Regenerative Biology) [ https://www.mountsinai.org/profiles/bo-chen].
«Наше исследование является первым, показывающим, что активация пути CaMKII (кальциевого канала – ред.) помогает защитить ганглиозные клетки сетчатки от различных повреждений и в нескольких моделях глаукомы», – сказал этот ученый.
Это означает, что управлять глаукомным процессом в будущем станет возможным через коррекцию работы нейронной сети, а точнее, трансмембранных переносов на генном уровне (пояснение см. в Терминологическом словаре – ред).
Терминологический словарь

Биологический термин «модулятор»
Служит для описания тонких механизмов передачи нервных импульсов между компонентами нейронной сети, так называемой нейротрансмиссии. Эти агенты «подают сигнал к началу метаболических процессов внутри клетки» (см. https://kineziolog.su/content/mediatory-i-modulyatory). Торможение или возбуждение выполняется другими агентами – медиаторами (посредниками). В указанной ссылке поясняется также: «…медиаторы могут открывать ионные каналы и тем самым запускать трансмембранные потоки ионов – как положительных, кальция или натрия (возбуждающих), так и отрицательных хлора (тормозящих).
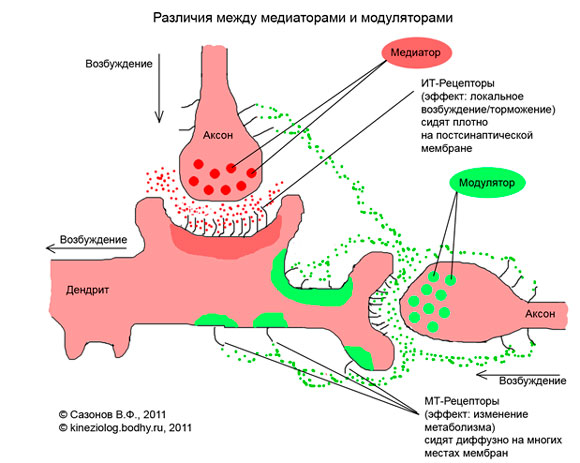
Модуляторы же «…сидят отдельно от ионных каналов на любом месте мембраны. С внутренней стороны мембраны к этим рецепторам присоединяются G-белки. Когда модулятор связывается с метаботропным рецептором, то G-белок активируется и запускает каскад биохимических реакций внутри клетки. Таким способом модулируется (т.е. направленно изменяется) внутреннее состояние клетки. Модуляторов намного больше, чем медиаторов (соответственно более 600 и не более 30). См. также рисунок.
Генная терапия
Генная терапия доставляет ген в клетки, чтобы компенсировать дефектный ген. Но при этом не происходит удаление дефектной ДНК из клеток. При редактировании генома происходит удаление или изменение дефектной ДНК в клетках пациента [см. https://blog.genotek.ru/gene-therapy-practice]
Ганглиозная клетка
Ганглиозная клетка — нервная клетка (нейрон) сетчатки глаза, способная генерировать нервные импульсы [Wikipedia]
Авторы этого проекта исходят из возможностей современной нейробиологии, позволяющих корректировать работу конкретных участков нейронной сети. Объектом коррекции может быть, в частности, кальциевый канал переноса CaMKII (кальций / кальмодулин-зависимая протеинкиназа II), который регулирует ключевые клеточные процессы и функции по всему организму, включая ганглиозные клетки сетчатки.
Известно, что для глаукомы характерна нейродегенерация (зрительного нерва), то есть «разорванная» передача нервных импульсов (сигналов) от глаза к мозгу. Доступные и традиционные методы лечения открытоугольной первичной глаукомы замедляют потерю зрения за счет снижения повышенного глазного давления глазными каплями, однако при некоторых формах глаукомы утеря зрения прогрессирует даже на фоне нормализованного глазного давления (или изначально нормального).
Именно для таких форм глаукомы – «глаукома с нормальным давлением» – нейропротекторная терапия прежде всего станет шагом вперед к спасению зрения
Тем не менее, точная роль CaMKII в здоровье ганглиозных клеток сетчатки до конца не установлена. По имеющимся противоречивым данным, подавление активности CaMKII является либо защитным, либо пагубным для ганглиозных клеток сетчатки, в зависимости от условий.

В том случае, когда мышам проводили генную терапию непосредственно перед применением острого повреждающего воздействия (химического или физического), отмечалось быстрое увеличение активности кальциевого канала и более сохранное состояние клеток сетчатки. Сообщается, что у подопытных мышей, получавших генную терапию, 77% ганглиозных клеток сетчатки были живы (выжили) через 12 месяцев после токсического воздействия по сравнению, тогда как в контрольной группе животных выжили лишь 8% клеток сетчатки. Через 6 месяцев после механического повреждения зрительного нерва выжили также 77% ганглиозных клеток сетчатки по сравнению с 7% в контроле.
Такое же соотношение было получено на моделях глаукомы (учитывалось, что глаукома – наследственное заболевание). Показатель повышенного внутриглазного давления вводился как унаследованный фактор или привнесенный искусственно. Оказалось, что, действительно, бо́льшая выживаемость ганглиозных клеток соответствует большей вероятности сохранения зрительной функции глаза и эта сохранность более устойчива и надежна. Такой вывод был подтвержден экспериментально поведенческими тестами мышей, переживших упомянутые выше повреждения ганглиев сетчатки (обучение плаванию на притопленной платформе, тест на восприятие глубины, тест на защитную реакцию на приближение).

Более того, генная терапия позволяет противостоять старению сетчатки.
Обозреватели портала GRF сообщают о многообещающем научном прорыве специалистов Гарвардской медицинской школы, которым удалось реабилитировать поврежденные глаукомой гены зрительных структур грызунов, то есть «омолодить» нервные клетки сетчатки, замедлить их старение. Это направление получило название «новой генной терапии».
Новый подход, который успешно устраняет потерю зрения у мышей без трансплантации сетчатки, представляет собой потенциально новый метод лечения в регенеративной медицине.

Австралийский ученый Дэвид Синклер, ведущий разработчик этого направления, специалист мирового уровня по биогеронтологии, заявил: «Наше исследование демонстрирует, что можно безопасно обратить вспять возраст сложных тканей, таких как сетчатка, и восстановить их биологическую функцию, какой она была в молодости».
Сообщение об этом уникальном достижении впервые появились в конце 2020 года. Научному сообществу через журнал “Nature” была предложена революционная по сути рабочая гипотеза о том, что в принципе возможно «безопасно перепрограммировать сложные ткани, такие как нервные клетки глаза, на более ранний возраст», или «перевести назад (в оригинале – обнулить – ред.) стрелки часов старения». Авторы вполне обоснованно предполагают, что этот подход, если его эффект удастся устойчиво воспроизводить, может дать начало терапии нового поколения, способной прерывать старение и возрастные заболевания.

На этой оптимистической ноте мы завершаем публикации 2021 года и уходим на новогодний перерыв до конца января.
Всем здоровья, надежд и новых знаний о глаукоме и «попутных» проблемах.
До новых встреч на сайте.

