Арутюнян Лусине Левоновна
Автореферат диссертации на соискание ученой степени доктора медицинских наук
Работа выполнена на кафедре офтальмологии Федерального государственного бюджетного образовательного учреждения дополнительного профессионального образования «Институт повышения квалификации Федерального медико- биологического агентства»
Научные консультанты:
доктор медицинских наук Анисимов Сергей Игоревич доктор биологических наук, профессор Иомдина Елена Наумовна
Официальные оппоненты:
Еричев Валерий Петрович, доктор медицинских наук, профессор, Федеральное государственное бюджетное научное учреждение «Научно-исследовательский институт глазных болезней», руководитель отдела глаукомы
Страхов Владимир Витальевич, доктор медицинских наук, профессор, Государственное бюджетное образовательное учреждение высшего профессионального образования «Ярославский государственный медицинский университет» Министерства здравоохранения РФ, заведующий кафедрой офтальмологии
Алексеев Игорь Борисович, доктор медицинских наук, профессор, Государственное бюджетное образовательное учреждение дополнительного профессионального образования «Российская медицинская академия последипломного образования» Министерства здравоохранения РФ, профессор кафедры офтальмологии
Ведущая организация: Государственное бюджетное образовательное учреждение высшего профессионального образования «Российский национальный исследовательский медицинский университет имени Н.И.Пирогова» Министерства здравоохранения РФ
Защита диссертации состоится 27 апреля 2016 г. в 14 часов на заседании диссертационного совета Д 208.120.03 при ФГБОУ ДПО ИПК ФМБА России по адресу: 123098 Москва, Волоколамское шоссе, д. 91
С диссертацией можно ознакомиться в библиотеке ФГБОУ ДПО ИПК ФМБА России по адресу: 123098 Москва, Волоколамское шоссе, д. 91
Автореферат разослан «_ » 2016 г.
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор Овечкин Игорь Геннадьевич
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы и степень ее разработанности
Первичная открытоугольная глаукома (ПОУГ) занимает лидирующее место среди ведущих причин неустранимой слепоты в мире. В Российской Федерации более 1 млн. больных глаукомой, более 150 тыс. инвалидов по зрению вследствие глаукомы и около 70 тыс. являются слепыми от глаукомы, при этом около 28% случаев первичной инвалидности по зрению связаны с данным заболеванием (Е.С. Либман, 2009; В.В. Нероев, 2013). Таким образом, проблема глаукомы представляется особенно важной с медико-социальных позиций (В.П. Еричев, Е.А. Егоров, 2014).
К настоящему моменту в практической офтальмологии разработаны и успешно апробированы различные направления диагностики и лечения ПОУГ, однако во многих случаях, несмотря на проведенное лечение, глаукомная оптическая нейропатия неуклонно прогрессирует. В связи с этим углубленное изучение механизмов ее развития и разработка новых подходов к лечению этого заболевания представляется весьма актуальной научной задачей.
В первую очередь следует отметить, что, по мнению ряда авторов, поражению зрительного нерва при ПОУГ способствует патологическое ускорение возрастных структурных и биохимических изменений решетчатой пластинки (J. Albona, 2000;
M. Hernandez, 2008). Однако изменения структурно-биомеханических особенностей собственно склеры и корнеосклеральной оболочки глаза в целом при глаукомном поражении изучены пока явно недостаточно. В то же время показано, что биомеханические показатели роговицы влияют на результаты измерения внутриглазного давления (C.Э. Аветисов, 2013). Кроме того, по мнению В.В. Волкова (2001), течение глаукомного процесса может в определенной степени зависеть от биомеханических свойств склеры. Изложенные положения объясняют возрастающий интерес к исследованию биомеханики корнеосклеральной оболочки глаза при глаукоме (Е.Н. Иомдина, 2009; В.В. Страхов, 2009).
Очевидно, что биомеханические свойства склеры при глаукоме напрямую зависят от состояния ее главных фибриллообразующих биополимеров – коллагена и эластина, однако сведений такого рода в литературе практически нет. В то же время в последние годы появились новые технологии визуализации структурных особенностей различных биологических тканей, в частности, нелинейная оптическая микроскопия (НЛОМ), часто называемая мультифотонной микроскопией (K. Schenke–Layland, 2008; W. Zipfel, 2003; Е.В. Митрошина, 2012), которая обеспечивает визуализацию трехмерных структур с субмикронным разрешением, достигаемым за счет использования нелинейного возбуждения. Данный метод предоставляет возможность детального изучения морфологии тканей глаза и, в частности, соединительной ткани, ее клеточных элементов, коллагеновых волокон и пучков (R. Williams, 2005). За формирование образа объекта отвечают два типа сигналов – генерация второй гармоники (ГВГ) и двухфотонная флуоресценция (ДФФ). НЛОМ с одновременной регистрацией ГВГ и ДФФ позволяет разделить важнейшие структурные компоненты соединительной ткани – коллаген и эластин. По-видимому, изучение коллагеновых и эластиновых структур глаукомной склеры с помощью НЛОМ позволит получить новую информацию о патогенезе глаукомного поражения.
Известно, что структурная стабильность соединительной ткани, в том числе и склеры, в большой степени определяется количеством внутри- и межмолекулярных поперечных связей (Е.Н. Иомдина, 1993, 2007). Для определения уровня поперечной связанности соединительной ткани используют измерение тепловых эффектов денатурации, в частности, температуры (Тm) и энтальпии денатурации (DHm) с помощью дифференциальной сканирующей калориметрии (ДСК), при этом важно подчеркнуть, что указанные параметры здоровых и патологически измененных тканей существенно различаются между собой (S. Vyazovkin, 2007). Исследование поперечной связанности склеры в возрастном аспекте и при ПОУГ путем определения термодинамических параметров денатурации коллагена представляется существенным шагом в понимании этиологии заболевания, его диагностики, и может служить основанием для разработки патогенетической терапии.
Особо следует отметить, что с современных позиций при выборе оптимальной терапии глаукомы необходимо учитывать выраженность и характер изменений биомеханических свойств склеры (Е.Н. Иомдина с соавт., 2011, 2015; H. Quigley, 2012). Отдельные исследования в данном направлении были связаны с применением быстроинтегрирующегося коллагена для уменьшения механических напряжений в перипапиллярной зоне склеры (С.Ю. Анисимова, С.И. Анисимов, 2012). Положительные эффекты предложенных алгоритмов лечения определяют актуальность их дальнейшей всесторонней оценки.
Представление о механическом повреждении структур зрительного нерва при повышении ВГД при глаукоме привело к появлению нагрузочных проб, основанных на создании искусственной гипертензии и сравнении исходных параметров с полученными в ходе такой нагрузки (В.В. Волков, 1981; Ю.С. Астахов, 2003). Накопленные данные говорят о возможности использования компрессионных проб для прижизненного изучения биомеханических особенностей глаукомных глаз и диагностики глаукомы. Информация об особенностях деформаций тканей в области ДЗН при компрессионной нагрузке может расширить наши представления о механизмах развития экскавации ДЗН и позволит разработать новые методы ее диагностики и лечения.
Таким образом, проблема комплексного исследования состояния корнеосклеральной оболочки глаза в контексте обоснования новых подходов к диагностике и лечению ПОУГ требует более широкого изучения, как в концептуальном плане, так и по отдельным направлениям.
Цель работы
Комплексное изучение патогенетических механизмов развития ПОУГ, связанных с патологией корнеосклеральной оболочки глаза, определение значимости изменений структурно-механических свойств склеральной ткани в прогрессировании глаукомного процесса и разработка на этой основе новых подходов к диагностике и лечению этой офтальмопатологии.
Основные задачи работы
- Провести сравнительное исследование коллагенового каркаса и эластических волокон склеральной ткани в норме и у пациентов с ПОУГ методами нелинейно- оптической (мультифотонной) и световой микроскопии.
- Провести изучение возрастных особенностей уровня поперечной связанности коллагена склеры и теноновой капсулы пациентов с разными стадиями ПОУГ.
- Изучить взаимоотношения структурно-функциональных параметров и уровня поперечной связанности коллагена склеры глаукомных глаз.
- Изучить микроэлементный состав биоптатов склеры, влаги передней камеры и слезной жидкости у пациентов с глаукомой различных стадий и установить корреляционную зависимость между содержанием значимых микроэлементов в этих биологических жидкостях и степенью глаукомного поражения.
- На основе комплексного корреляционного анализа связи между местным микроэлементным балансом и клиническими структурно-функциональными показателями глаз с различными стадиями глаукомы выявить микроэлементы, наиболее тесно связанные с развитием глаукомного процесса.
- Оценить эффективность выбранного средства системной коррекции микроэлементного дисбаланса у пациентов с различными стадиями ПОУГ на основании динамического анализа структурно-функциональных параметров глаза.
- Оценить диагностическую и прогностическую значимость изменений биомеханических параметров корнеосклеральной оболочки глаза и морфометрических параметров ДЗН в условиях дозированного подъема ВГД в норме и у пациентов с ПОУГ.
Основные положения, выносимые на защиту диссертационной работы
- Исследование показателей состояния корнеосклеральной оболочки глаза является отдельным направлением персонализированной системы диагностики и лечения пациентов с ПОУГ, что подтверждается высоким уровнем корреляционной взаимосвязи между базовыми параметрами коллагенового каркаса и эластических волокон в склеральном матриксе и степенью прогрессирования глаукомного процесса, а также клинической эффективностью препаратов, нормализующих структурно-биомеханические характеристики корнеосклеральной оболочки глаза.
- Ремоделирование матрикса склеры может рассматриваться в качестве одного из ведущих факторов риска развития глаукомного процесса. Формирование избыточных сшивок коллагеновых структур склеры, связанное с глаукомным поражением, играет более существенную роль в нарушении ее структурно-биомеханических свойств, чем сшивание коллагеновых комплексов, вызванное естественным процессом старения, поскольку различия по термомеханическим показателям Тm и DHm между разными возрастными группами менее значительны, чем различия, связанные с прогрессированием
- Нарушение микроэлементного состава сред и тканей глаза пациентов с различными стадиями ПОУГ (снижение уровня магния и цинка, повышение уровня железа) способствует росту поперечного сшивания коллагена склеры и оказывает негативное влияние на структурно-функциональное состояние глаза. Дополнительное (к необходимому медикаментозному гипотензивному режиму) системное применение магнийсодержащего препарата приводит к статистически значимому повышению биомеханических и функциональных показателей, позволяет стабилизировать глаукомный процесс.
- Комплексный метод оценки изменений биомеханических показателей корнеосклеральной оболочки глаза и параметров ДЗН при дозированном подъеме ВГД позволяет своевременно диагностировать ПОУГ и прогнозировать течение глаукомного процесса.
Научная новизна работы
Впервые выполнена комплексная оценка состояния корнеосклеральной оболочки глаза пациентов с различными стадиями ПОУГ по структурным, биохимическим, термомеханическим, микроэлементным и биомеханическим показателям.
Разработана персонализированная система диагностики и лечения пациентов с ПОУГ, основанная на оценке состояния корнеосклеральной оболочки глаза.
Впервые в офтальмологической практике патогенетически обосновано новое направление медикаментозной терапии пациентов с ПОУГ.
Установлены статистически достоверные нарушения коллагеновой структуры теноновой капсулы глаз с ПОУГ, зависящие от стадии глаукомного процесса (р=0,009 по U-критерию Манна-Уитни).
Впервые методами нелинейно-оптической (мультифотонной) и световой микроскопии выявлены морфологические особенности деструкции коллагеновых и эластических волокон при различных стадиях глаукомного процесса.
Установлены статистически значимые различия термомеханических параметров Тm и DHm, отражающих уровень сшивания коллагеновых комплексов склеры при ПОУГ (в пределах 1,9-2,70С и 4,0-7,5 Дж/г сухого остатка соответственно) и при естественном старении (в пределах 0,8-1,00С и 0,3-2,1 Дж/г сухого остатка соответственно).
Определены статистически достоверные прямые корреляционные взаимоотношения уровня поперечной связанности коллагена склеры со структурно-функциональными параметрами глаз с ПОУГ (R=0,61, р<0,05).
Установлено, что уровень поперечной связанности коллагена склеры наиболее значимо коррелирует с периметрическими показателями и структурными параметрами ДЗН (R=0,65, р=0,015 и R=0,73, р=0,009, соответственно) у относительно молодых пациентов с ПОУГ.
Выявлено, что ткани и среды глаз пациентов с ПОУГ характеризуются дефицитом магния (снижение по сравнению с нормой в 1,3-1,6 раз, р<0,05), что определяет необходимость включения в лечение ПОУГ магнийсодержащих препаратов.
Определено стабилизирующее влияние лекарственного средства Магнерот на течение глаукомного процесса при его включении в комплекс лечения пациентов с ПОУГ в качестве дополнения к необходимому медикаментозному гипотензивному режиму, что проявляется статистически значимой положительной динамикой периметрических индексов MD и PSD (на 16,7% и 15,1% соответственно, р<0,05).
Доказана диагностическая значимость изменений корнеального гистерезиса и параметров ДЗН (чувствительность метода – 93%, специфичность метода – 87%) при двух разных уровнях дозированного подъема ВГД у лиц с подозрением на глаукому.
Установлен относительно более низкий уровень поперечной связанности коллагена склеры на фоне гипотензивной терапии аналогами простагландинов и их благоприятное воздействие на биомеханические и структурно- функциональные показатели глаукомных глаз со статистически значимой положительной динамикой значений корнеального гистерезиса (на 19,6%, р<0,05).
Теоретическая значимость работы заключается в раскрытии патогенетических механизмов развития ПОУГ, связанных с патологией соединительной ткани, в выявлении значимости изменений структурно-механических свойств склеральной ткани в прогрессировании глаукомного процесса, что создает основу для разработки новых подходов к диагностике и лечению этой офтальмопатологии. Определены возрастные особенности ремоделирования матрикса глаукомной склеры как предрасполагающего фактора развития и прогрессирования глаукомного поражения. Выявлены нарушения микроэлементного состава, а также коллагеновой структуры склеры и теноновой капсулы, зависящие от стадии глаукомного процесса и возраста манифестации, что предполагает наличие генерализованного поражения соединительнотканных структур глаза и доказывает необходимость назначения препаратов, нормализующих структурно- биомеханические характеристики корнеосклеральной оболочки, в первую очередь относительно молодым пациентам с ПОУГ.
Практическая значимость работы определяется разработкой (с учетом комплексной оценки состояния корнеосклеральной оболочки глаза) диагностических, профилактических и лечебных мероприятий, обеспечивающих существенное повышение клинико-функциональных результатов диагностики и лечения пациентов с различными стадиями ПОУГ.
Методология и методы исследования
В работе применялся комплексный подход к оценке состояния корнеосклеральной оболочки глаза на основе применения структурно- морфологических, биохимических, термомеханических, микроэлементных и биомеханических методов исследования.
Степень достоверности результатов
Достоверность результатов исследования определяется достаточным и репрезентативным объемом выборок. Исследование проведено в стандартизированных условиях и на материале, достаточном для выполнения поставленных задач. В работе использовано современное сертифицированное оборудование. Анализ результатов исследования и статистическая обработка выполнены с применением современных методов сбора и обработки научных данных.
Внедрение результатов работы
Материалы диссертационного исследования внедрены в научно-практическую и педагогическую деятельность кафедры офтальмологии ФГБОУ ДПО “Институт повышения квалификации Федерального медико-биологического агентства”, кафедры глазных болезней Московского государственного медико- стоматологического университета им. А.И. Евдокимова, включены в материалы сертификационного цикла и цикла профессиональной переподготовки, в клиническую работу ООО Глазной центр «Восток-Прозрение». Результаты работы включены в учебно-методическое пособие «Коллагенопластика дренажных путей и заднего полюса глаза как способ хирургического лечения различных клинических форм глаукомы» (2013 г.).
Апробация и публикация материалов исследования
Материалы диссертации доложены на VIII и XI Всероссийских научно- практических конференциях с международным участием «Федоровские чтения» (Москва, 2009, 2013), на 3-ем и 5-ом Всемирных Глаукомных конгрессахWGC (Boston, 2009, Vancouver, 2013), на VII Международной научно-практической конференции «Пролиферативный синдром в офтальмологии» (Москва, 2012), на VI, VII и VIII Российских Общенациональных офтальмологических форумах (Москва, 2013, 2014 и 2015), на конгрессах Российского глаукомного общества
«Глаукома: теории, тенденции, технологии» (Москва, 2013 и 2014), на VI конференция «Глаукома: теория и практика» (Санкт-Петербург, 2013), на XIII и XIV Всероссийских школах офтальмолога (Снегири, 2014 и 2015), на конференции «Возможности высокотехнологичной офтальмологической помощи пациентам с тяжелой витреоретинальной патологией в условиях многопрофильного стационара» (Москва, 2013), на Межрегиональной научно- практической конференции офтальмологов Нижегородской области (Нижний Новгород, 2013), на краевой научно-практической конференции «Актуальные вопросы организации офтальмологической помощи» (Красноярск, 2014), на 10-ом съезде офтальмологов России (Москва, 2015), на 10-ом Европейском глаукомном конгрессе EGS (получен диплом за лучший доклад, Copenhagen, 2012), на XXXI европейском конгрессе катарактальных и рефракционных хирургов ESCRS (Amsterdam, 2013), на 11-ом Европейском глаукомном конгрессе EGS (Nice, 2014), на VII Евро-Азиатской конференции по офтальмохирургии (Екатеринбург, 2015), на конференции «Актуальные вопросы в офтальмологической практике (Пенза, 2015), на межрегиональной научно-практической конференции «Актуальные вопросы в офтальмологии» (Ижевск, 2015).
Материалы диссертации представлены в 51 научной работе, в том числе в 18 статьях, опубликованных в определенных ВАК РФ ведущих рецензируемых научных журналах.
Структура и объем диссертации
Диссертация изложена на 250 страницах машинописного текста, состоит из введения, обзора литературы, 6 глав собственных исследований, заключения, выводов и практических рекомендаций. Работа иллюстрирована 23 таблицами и 80 рисунками. Список литературы содержит 350 источников (130 – отечественных и 220 – иностранных).
СОДЕРЖАНИЕ РАБОТЫ
Материал и методы исследования
Для решения поставленных задач был использован комплекс специальных методов исследования: мультифотонная и световая микроскопия, термомеханический, биохимический, флуоресцентный и микроэлементный анализ, вакуум-компрессионная нагрузочная проба, а также современные методы клинико-инструментального исследования офтальмологического статуса. Всего было обследовано 426 пациентов в возрасте от 50 до 91 года с различными стадиями ПОУГ, с подозрением на глаукому и лица без офтальмопатологии (кроме возрастной катаракты), составившие группу контроля. Исследовано 182 образца тканей и сред глаза.
С помощью мультифотонной и световой микроскопии изучены 22 образца склеры, полученные во время непроникающей глубокой склерэктомии (НГСЭ) у пациентов в возрасте 61-64 лет (средний возраст 62,7±1,2 лет) с I, II и III стадией ПОУГ. Контролем служили образцы склеры 6 глаз в возрасте 52-57 лет (средний возраст 55,2±1,3 лет), которые были получены при хирургическом лечении острой травмы глазного яблока у больных, которые ранее не имели никакой офтальмопатологии. Для получения ГВГ и ДФФ изображений образцы склеры фиксировали в 10% нейтральном формалине. Изображения получали с помощью системы лазерной сканирующей микроскопии LSM 510 META (Carl Zeiss, Германия). Для верификации полученные результаты сравнивали с данными гистологии: срезы склеры толщиной 4-5 мкм исследовали методом световой микроскопии с окраской гематоксилин-эозином, пикрофуксином по Ван Гизону на коллагеновые волокна, орсеином по методу Унна на эластические волокна и методом комбинированной окраски коллагеновых и эластических волокон.
С целью изучения структурно-биомеханических особенностей склеральной ткани глаукомных глаз методом термомеханического, биохимического и флуоресцентного анализа у 75 пациентов в возрасте 50-91 года (средний возраст 67,4±7,5 лет) с различными стадиями ПОУГ во время проведения НГСЭ были взяты образцы склеры и у 12 пациентов в возрасте 53-58 лет (средний возраст 55,8±1,7 лет) – образцы теноновой капсулы. Всем пациентам проведено поперечное клинико-инструментальное исследование офтальмологического статуса. У 8 пациентов без глаукомы (группа контроля) в возрасте 43-47 лет (средний возраст 46±0,9 лет) были взяты образцы теноновой капсулы во время операциии справления косоглазия или посттравматического вмешательства. Для оценки термомеханических показателей склеры использовали современный высокотехнологичный метод ДСК (калориметр «Phoenix DSC 204», Netzsch, Германия). Аминокислотный состав склеры (упаренного гидролизата) определяли с помощью аминокислотного анализатора (Hitachi-835, Япония) с предварительным катионообменным разделением и последующей фотометрической реакцией с нингидрином. После термического анализа образцы использовались для флуоресцентного анализа. Спектры флуоресценции регистрировали на спектрофлюорофотометре.
Для микроэлементного анализа в первой части работы проведено одномоментное (поперечное) клинико-инструментальное исследование офтальмологического статуса и микроэлементный анализ проб водянистой влаги (0,1-0,2 мл) и образцов склеральной ткани 23 пациентов в возрасте 53-79 лет (средний возраст 64,2±7,8 лет) с различными стадиями ПОУГ. Образцы склеры были получены при синустрабекулэктомии с профилактической задней трепанацией склеры. Контролем служили пробы камерной влаги, полученные при экстракции незрелой сенильной катаракты у 18 пациентов в возрасте 54-70 лет (средний возраст 62,3±4,9 лет), а также ткани 8 глаз без глаукомы той же возрастной группы, удаленных вследствие тяжелой глазной травмы. Микроэлементный анализ слезной жидкости, влаги и склеры проводили на масс- спектрометре с ионизацией в индуктивно-связанной плазме фирмы “Перкин Элмер” ELANDRCII (США). Во второй части работы для оценки эффективности терапии ПОУГ магнийсодержащим препаратом магнерот проведен анализ результатов динамического обследования 61 пациента (69 глаз) с различными стадиями компенсированной ПОУГ, из них 32 пациента (38 неоперированных глаз) в возрасте 48-74 лет (средний возраст 61,1±3,5 года) составили основную группу и 29 пациентов (31 неоперированный глаз) в возрасте 49-79 лет (средний возраст 63,7±3,7 года) – группу контроля. Пациентам основной группы на фоне инстилляционного гипотензивного режима (включавшего в зависимости от индивидуального состояния бета-блокаторы, ингибиторы карбоангидразы, аналоги простагландинов) для коррекции дефицита магния назначали перорально препарат магнерот в соответствии с инструкцией по его применению: ежедневно по 2 табл. 3 раза в день в течение 7 дней, затем по 1 табл. 3 раза в день. Общая продолжительность приема препарата составляла 8 недель. Магнерот (ВЕРВАГ ФАРМА ГмбХ и КоКг, ФРГ) содержит магний в биодоступной форме – в виде магния оротатадигидрата (32,8 мг в пересчете на чистый магний), что усиливает его абсорбцию и транспорт в клетку. Препарат магнерот содержит оротовую кислоту, в связи с этим обладает не только высокой биодоступностью, но и рядом дополнительных (синергичных) эффектов, связанных с ее биологической ролью. Важным преимуществом этого препарата является его самостоятельное кардиопротекторное и антисклеротическое действие, что, безусловно, важно для пациентов старшего возраста с ПОУГ. Препарат положительно воздействует на энергетический метаболизм, структуру соединительной ткани, сосудистый тонус и обладает нейропротекторным действием (А.Ю. Гоголев, 2010). Пациенты группы контроля находились на аналогичном индивидуальном гипотензивном режиме, но магнерот не применяли. У 23 пациентов 51-69 лет (средний возраст 61,1±2,5 года) основной группы проведен микроэлементный анализ проб слезной жидкости, взятых до и после курса лечения магнеротом.
Для оценки эффективности консервативного и хирургического лечения ПОУГ методом вакуум компрессионной нагрузочной пробы обследован 71 больной (82 глаза) с подозрением на глаукому и верифицированным диагнозом ПОУГ в возрасте от 51 до 80 лет (средний возраст 65,4±6,9 лет): с подозрением на глаукому – 29 глаз, с ПОУГ – 32 глаза, с ПОУГ после проведения периневральной склеропластики (ПС) материалом Ксенопласт – 21 глаз. Для дозированного повышения ВГД применяли индикатор вакуум-компрессионного теста (фирма СКТБ офтальмологического приборостроения «Оптимед», Россия). Все исследования проводили на двух уровнях вакуума (уменьшение давления в системе относительно атмосферного создавалось на -60 и -80 мм рт.ст.). Для сравнительной оценки полученных показателей проведено исследование биомеханических свойств оболочек глаза и параметров ДЗН в условиях дозированного подъема ВГД у 31 человека без офтальмопатологии (59 глаз), которые составили контрольную группу. Средний возраст здоровых лиц не отличался от такового в группах наблюдения и составил 62,8±6,7 лет (от 49 до 78 лет).
Для оценки эффективности гипотензивной терапии аналогами простагландинов по результатам изменений корнеального гистерезиса было проведено динамическое наблюдение 58 пациентов (63 глаза) с ПОУГ в течение 36 – 42 месяцев. Средний возраст пациентов составил 69,6±5,2 года при разбросе показателей от 56 до 84 лет.
Результаты работы и их обсуждение
На основании данных, полученных при изучении образцов склеры методом нелинейно-оптической и световой микроскопии, можно сделать вывод о специфической дезорганизации структуры коллагеновых и эластических волокон в глаукомной склере. Установлено, что участки уплотненного расположения коллагеновых пучков сочетаются с их диссоциацией в других участках склеры, отмечается расщепление пучков и волокон коллагена при сохранении его молекулярной структуры. Однако данные НЛОМ и гистологии (фуксинофилия волокон по Ван-Гизону), свидетельствуют о сохранении молекулярной структуры коллагена. Эластические волокна также подвергаются выраженным изменениям: отмечается неравномерность их распределения, диссоциация с коллагеновыми волокнами, деструкция, фрагментация, образование клубков, завитков и спиралей (рисунок 1 а, б, в). Все эти нарушения, несомненно, изменяют механические свойства, в частности, эластичность соединительной ткани склеры.
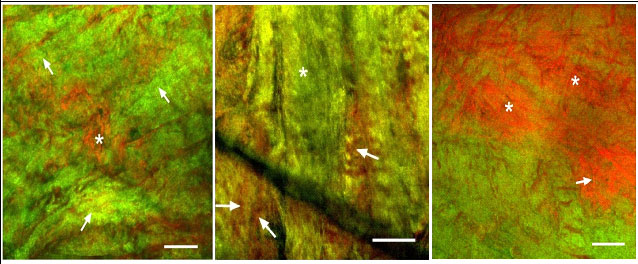
а) I стадия б) II стадия в) III стадия
Рисунок 1 – НЛОМ изображение наружной поверхности склеры глаз с разными стадиями ПОУГ (совместное представление ГВГ/ДФФ): а) разрыхление коллагеновых пучков (стрелки) и образование клубков эластических структур (звездочка); б) область диссоциации коллагенового пучка с отсутствием эластических волокон (звездочка), стрелками показаны очаги сгущения измененных эластических волокон; в) концентрация беспорядочных эластических волокон (звездочки) и их спирализация (стрелка). Бар 50 мкм.
Изменения коллагенового каркаса и эластических волокон в склеральном матриксе, нарастающие по мере развития глаукомного поражения, выявляются как с помощью световой, так и нелинейно-оптической микроскопии. Такое совпадение результатов двух методов указывает на корректность использования НЛОМ для адекватного описания структурных особенностей внеклеточного матрикса склеральной ткани. При этом использование новой технологии визуализации позволяет получить более детальную информацию о состоянии волокнистых структур внеклеточного матрикса склеры глаукомных глаз. Проведенное исследование позволяет предположить, что ремоделирование матрикса глаукомной склеры может быть одним из предрасполагающих факторов развития глаукомы, т.к. оно обнаруживается уже на I стадии болезни. В дальнейшем сами структурные изменения могут быть ответом на повышение ВГД выше толерантных значений. Возможно, таким образом развивается негативная обратная связь, способствующая прогрессированию глаукомы.
Сравнительное изучение возрастных особенностей уровня поперечной связанности коллагена склеры показало, что для пациентов в возрастной категории от 50 до 59 лет с I стадией глаукомы характерен эндотермический переход коллагена склеры в денатурированное состояние со средним температурным пиком Tm=64,8±0,060C и энтальпией DHm=8,8±4,4Дж/г сухого остатка, с II стадией ПОУГ Tm=65,2±0,30C, DHm=14,0±5,8 Дж/г сухого остатка, с III стадией Tm=66,1±0,80C, DHm=14,3±3,4 Дж/г сухого остатка. Термомеханические параметры достоверно отличаются в I и II (p=0,01), II и III (p=0,03), I и III (p=0,0001) стадиях ПОУГ.
При анализе образцов склеры пациентов в возрастной категории от 60 до 69 лет получены несколько другие данные, показывающие рост Tm по сравнению с предыдущим возрастным периодом: для I стадии глаукомы характерен эндотермический переход со средним температурным пиком Tm=65,6±0,70C и
DHm=6,8±2,9 Дж/г сухого остатка, для II стадии Tm=66,0±1,30C и
DHm=12,2±3,4Дж/г сухого остатка, для III стадии Tm=66,2±0,80C и
DHm=13,7±3,2Дж/г сухого остатка. Термомеханические параметры достоверно отличаются в I и II (p=0,04), I и III (p=0,0001) стадиях ПОУГ, и разница не достоверна между II и III (p=0,12) стадиями. Незначительный дальнейший рост Tm отмечен у пациентов в возрастной категории от 70 лет и старше: при I стадии глаукомы выявлен эндотермический переход со средним температурным пиком Tm=65,9±1,30C и DHm=10,6±2,6 Дж/г сухого остатка, при II стадии Tm=66,4±0,80C и DHm=11,9±2,9 Дж/г сухого остатка, при III стадии Tm=66,7±0,90C и
DHm=14,6±3,1Дж/г сухого остатка. Термомеханические параметры достоверно отличаются только в I и III (p=0,03) стадиях ПОУГ, а между I и II (p=0,08), II и III (p=0,12) стадиями разница не достоверна (рисунок 2 а, б, в).
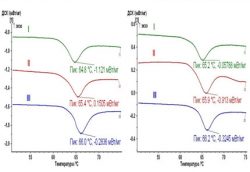  |
||
| а) 50-59 лет | б) 60-69 лет | в) 70-91 год |
| Рисунок 2 – ДСК-термограммы образцов склеры пациентов с различными стадиями глаукомы и разной возрастной категории: а) 50-59 лет; б) 60-69 лет; в) 70-91 год | ||
Получены статистически значимые отрицательные корреляционные взаимоотношения между корнеальным гистерезисом (КГ), характеризующим вязкоэластические свойства корнеосклеральной оболочки глаза, и энтальпией
DHm (R=-0,71, р<0,05), то есть у пациентов с высокими тепловыми эффектами отмечаются более выраженные изменения вязко-эластических свойств оболочки (рисунок 3).
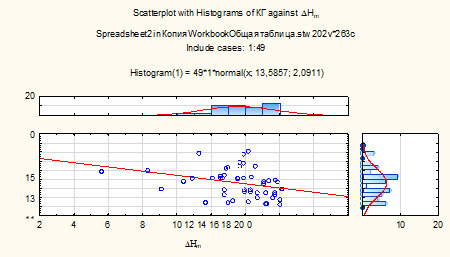
Рисунок 3 – Корреляционная зависимость между КГ и DHm у пациентов с ПОУГ
Анализ полученных данных позволяет заключить, что уровень поперечной связанности коллагена склеры глаукомных глаз зависит от возраста. Однако формирование избыточных сшивок, связанное с глаукомным поражением, по- видимому, играет более существенную роль в нарушении ее структурно- биомеханических свойств, чем сшивание коллагеновых комплексов, вызванное естественным процессом старения, поскольку различия по показателю Tm и DHm между разными возрастными группами (в пределах 0,8-1,00С и 0,3-2,1 Дж/г сухого остатка соответственно) оказались менее значительными, чем различия, связанные с прогрессированием глаукомного поражения (в пределах 1,9-2,70С и 4,0-7,5 Дж/г сухого остатка соответственно) (рисунок 4).
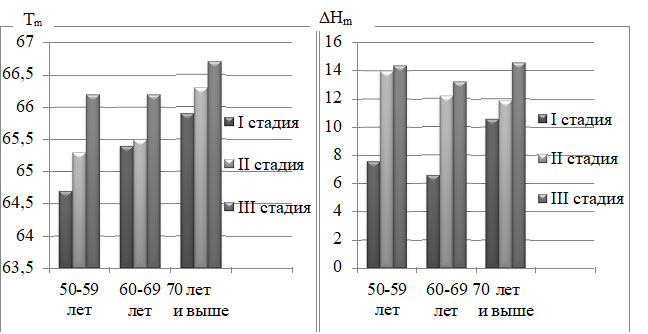
Рисунок 4 – Значения Tm и DHm склеры в зависимости от возраста и стадии ПОУГ Значимая корреляционная зависимость была выявлена между Tm и периметрическим индексом MD, Tm и вертикальным отношением площади ДЗН к площади экскавации в возрастной категории 50-59 лет (R=0,65, р=0,015 и R=0,73, р=0,009 соответственно) (рисунок 5).
Можно заключить, что у пациентов с относительно ранней манифестацией глаукомы значимость структурно-механических свойств склеральной ткани в прогрессировании глаукомного процесса достаточно велика.
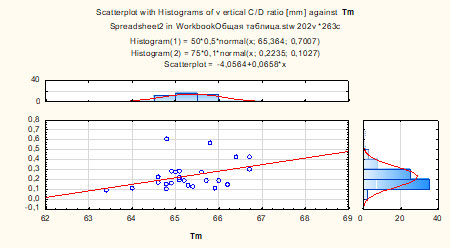
Рисунок 5 – Корреляционная зависимость между Tm и вертикальным отношением площади ДЗН к площади экскавации у пациентов с ПОУГ в возрастной категории 50-59 лет
Результаты исследования поперечной связанности коллагеновых структур склеры в зависимости от получаемой пациентами до операции гипотензивной медикаментозной терапии показывают, что при лечении аналогами простагландинов определяются относительно более низкие средние значения Tm=64,9±0,120C. Это соответствует менее выраженному уровню поперечной связанности коллагеновых структур склеры. У пациентов, находившихся на гипотензивном лечении бета-блокаторами и/или ингибиторами карбоангидразы, средние значения температуры денатурации были несколько выше и составили Tm=65,4±0,090C (р<0,05).
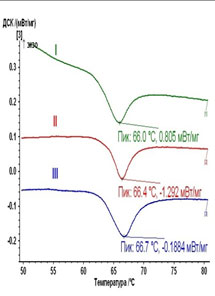
Данные ДСК позволили впервые выявить нарушения коллагеновой структуры не только склеры, но и теноновой капсулы глаз с глаукомой: повышение температуры денатурации и изменение формы кривой на ДСК-термограммах отражают деструкцию коллагеновой организации в этой ткани и зависят от стадии глаукомного процесса. Величины Tm и DHm в контрольной группе составили 69,9±0,320C и 20,1±1,6 Дж/г сухого остатка соответственно. Для пациентов с I стадией глаукомы характерен эндотермический переход со средним температурным пиком Tm=67,3±0,730C и DHm=22,6±1,4 Дж/г сухого остатка, при II стадии эти показатели выше: Tm=68,2±1,290C и DHm=24,1±1,9 Дж/г сухого остатка, при III стадии Tm=69,1±0,80C и DHm=27,8±2,1 Дж/г сухого остатка. Термомеханические параметры достоверно отличаются в норме и I стадии (p<0,05), I и II (p=0,03), II и III (p=0,03), I и III стадиях (p=0,007) ПОУГ (достоверность различий определена по U-критерию Манна-Уитни). Ремоделирование коллагеновой организации этой ткани, аналогичное глаукомной склере, позволяет рассматривать тенонову капсулу как ценный объект для изучения механизмов прогрессирования глаукомы.
Мы полагаем, что обнаруженное в данной работе повышение уровня поперечной связанности коллагена по мере развития глаукомного поражения связано с укреплением тканевого матрикса, повышением плотности фибрилл за счет ослабления действия коллагенолитических ферментов и вероятного усиления процессов сшивания трансглутаминазой. При этом уровень поперечной связанности коллагена склеры глаукомных глаз зависит от возраста. Однако, как показывают полученные нами данные, формирование избыточных сшивок, связанное с глаукомным поражением, по-видимому, играет более существенную роль в нарушении ее структурно-биомеханических свойств, чем сшивание коллагеновых комплексов, вызванное естественным процессом старения. Выявленные структурно-биомеханические изменения корнеосклеральной оболочки глаза у пациентов с ПОУГ неукладываются в рамки естественных геронтологических процессов, в их основе, очевидно, лежит нарушение метаболизма соединительнотканной оболочки. По-видимому, процесс старения (пусть даже и ускоренного) отличается от глаукомного ремоделирования склеры тем, что действуют другие механизмы, изменяющие проницаемость склеры и ее демпфирующую способность в результате воздействия повышенного ВГД. Возможно, исходно более выраженные индивидуальные возрастные изменения структурно-биомеханических свойств склеры могут способствовать возникновению и прогрессированию глаукомного поражения, однако инволютивные процессы, вызывающие естественную структурную перестройку склеральной ткани, следует рассматривать лишь как фон, на котором развиваются процессы ее патологического глаукомного ремоделирования. Развитие глаукомного поражения в относительно молодом возрасте характеризуется более высокой, чем у лиц с глаукомой старших возрастных групп, корреляционной связью уровня сшивок с функционально-структурным состоянием глаукомного глаза, в частности, с периметрическими индексами и объемом НРП. Можно заключить, что у пациентов с ранней манифестацией глаукомы значимость структурно-механических свойств склеральной ткани в прогрессировании глаукомного процесса очень велика. Это свидетельствует о важности назначения относительно молодым пациентам с ПОУГ препаратов, способных уменьшить количество сшивок и сделать склеру менее жесткой. При развитии глаукомы в более старшем возрасте глаукомные нарушения, по-видимому, накладываются на уже имеющиеся возрастные изменения и происходят на другом метаболическом фоне, при этом дополнительный рост поперечного сшивания коллагена склеры оказывает влияние на уровень ВГД. Полученные результаты также показывают, что у пациентов с гипотензивной терапией аналогами простагландинов определяется относительно менее выраженный уровень поперечной связанности коллагеновых структур склеры. Очевидно, значительная гипотензивная эффективность консервативной терапии ПОУГ аналогами простагландинов в какой-то степени обусловлена деградацией ими поперечных сшивок, что приводит к повышению проницаемости склеры и улучшению оттока внутриглазной жидкости.
На основании микроэлементного анализа влаги передней камеры установлено, что по мере прогрессирования глаукомного процесса происходит повышение уровня Fe, Са и снижение содержания Zn, Cu, Mg, Al, Si, B, Li. Эти различия свидетельствуют о повышенной вязкости внутриглазной жидкости при глаукоме, т.к. характер выявленного дисбаланса весьма схож с отклонениями, обнаруженными в содержании этих микроэлементов в крови пациентов с ПОУГ (J. Ge, 1992; R. Weale, 1982). По данным J. Ge, при ПОУГ отмечается нарушение реологических свойств крови (синдром «гипервязкости»), ассоциированное с аномальным уровнем перечисленных микроэлементов, что способствует ухудшению кровоснабжения глаукомного глаза и снижению зрительных функций. Выявленное нами повышенное содержание Fe в камерной влаге пациентов с ПОУГ, обладающего прооксидантным действием, коррелирует с высоким уровнем во внутриглазной жидкости железосодержащего белка трансферрина (G. Koliakos, 1996), что, безусловно, свидетельствует об активации процессов перекисного окисления на фоне ослабления антиоксидантной защиты в средах глаукомного глаза. Подтверждением снижения при ПОУГ резистентности внутриглазной жидкости к окислительному стрессу является также обнаруженный нами пониженный уровень Mg, который участвует в подавлении перекисных процессов. По мере прогрессирования ПОУГ уровень Mg в камерной влаге снижается: при I стадии он составляет 5,9±0,5 мг/кг, при II стадии – 4,7±0,6 мг/кг, а при ПОУГ III стадии – 3,0±0,4 мг/кг, в то время как при катаракте без глаукомы (группа контроля) этот показатель выше – 6,7±0,9 мг/кг (p=0,02) (таблица 1).
Таблица 1 – Содержание микроэлементов (мкг/кг) во влаге передней камеры пациентов с различными стадиями ПОУГ и при возрастной катаракте (М±SD)
| Элемент | Стадия глаукомы | Возрастная катаракта | |
|
I-II |
III |
||
| Al |
0,035±0,017 |
0,012±0,006* |
0,0311±0,007 |
| Ba |
0,0067±0,0023 |
0,00057±0,0003* |
0,0079±0,0028 |
| Cu |
0,0150±0,0011* |
0,0090±0,006* |
0,0210±0,009 |
| Fe |
0,146±0,051* |
0,220±0,058* |
0,053±0,014 |
| Mg |
5,9±0,51* |
3,0±0,43* |
6,70±0,94 |
| Mn |
0,0044±0,0006* |
0,0009±0,00008* |
0,0120±0,0035 |
| Si |
1,8±1,2 |
0,34±0,21* |
1,9±1,3 |
| Ti |
0,005±0,007 |
0,006±0,009 |
0,0058±0,0017 |
| Zn |
0,124±0,06 |
0,090±0,04* |
0,139±0,03 |
* – различие с группой контроля достоверно, p<0,05
Снижение во внутриглазной жидкости концентрации Mg, как естественного антагониста Са, способного конкурировать с ионами Са как на уровне трансмембранного переноса, так и на уровне внутриклеточных взаимодействий, вызывает особый интерес, поскольку Mg не только влияет на вязкость крови, снижая агрегационную способность тромбоцитов, но и поддерживает нормальный трансмембранный потенциал в электровозбудимых тканях, в том числе в сетчатке (C. Fleming, 2009). Согласно данным литературы, концентрация Mg в слезной жидкости здоровых глаз сравнима (или немного ниже) с его уровнем в сыворотке крови, т.е. составляет для лиц старшей возрастной группы 0,66-0,99 ммол/л (R. Giordano, 1983; А.Ю. Гоголев, 2010). В то же время результаты наших исследований показали, что при ПОУГ Mg в этой биологической жидкости выявляется практически в следовых количествах. Слезная жидкость, в отличие от других сред и тканей глаза, доступна для неинвазивного исследования, что имеет большое значение для возможного дальнейшего использования микроэлементного анализа в клинической практике.
Результаты проведенного нами микроэлементного анализа склеры глаукомных глаз выявили дисбаланс в содержании целого ряда микроэлементов. В частности, отмечено снижение содержания Zn, Cu и повышение уровня Fe и Сa. Целенаправленное изучение уровня Mg показало его значительное снижение по мере прогрессирования глаукомного поражения. Так, концентрация Mg в образцах склеры глаз с I стадией ПОУГ составляет 19,3±1,8 мг/кг, со II стадией – 18,7±1,7 мг/кг, а при ПОУГ III стадии – 17,5±1,2 мг/кг, что достоверно ниже уровня Mg в нормальной склеральной ткани передней области – 29±6,0 мг/кг (p=0,001).
Обнаруженный с помощью микроэлементного анализа сред и тканей глаз с глаукомой дефицит магния, необходимого как для защиты нейрональных элементов сетчатки и зрительного нерва от дегенеративных процессов, характерных для глаукомного поражения, так и для регуляции метаболизма патологически измененных соединительно-тканных структур глаукомных глаз, послужил основанием для включения магнийсодержащего препарата магнерот в комплекс лечения пациентов с ПОУГ в качестве дополнения к необходимому медикаментозному гипотензивному режиму.
Для оценки влияния коррекции уровня магния на динамику ВГД и биомеханические показатели корнеосклеральной капсулы пациентам основной группы с ПОУГ назначали магнерот. Пациенты группы контроля находились на аналогичном индивидуальном гипотензивном режиме, но магнерот не применяли. Результат микроэлементного анализа слезной жидкости пациентов основной группы показал, что уровень магния, определявшийся до лечения в следовых количествах, после лечения повысился до 0,26-0,30 мг/кг и составил в среднем 0,28±0,05 мг/кг, что было достоверно выше исходного уровня (p<0,05).
Некорригированная и максимально корригированная острота зрения пациентов основной группы оставались практически стабильными на протяжении всего периода наблюдения. Так, через 3 мес. после окончания приема препарата острота зрения без коррекции составила в среднем 0,41±0,17, в то время как исходно этот показатель был 0,37±0,16, при этом острота зрения с максимальной коррекцией за этот период не изменилась, составляя 0,91±0,13 как до, так и спустя 3 мес. после окончания курса лечения.
Установлено, что применение магнерота оказало статистически значимое воздействие на уровень ВГД, снижая его, по данным различных методов измерения, на 2,0-4,1 мм рт.ст. (таблица 2).
Таблица 2 – Динамика ВГД (мм рт.ст.) у пациентов основной группы (применявших магнерот) и группы контроля в течение срока наблюдения(М±SD)
|
ВГД |
Основная группа | Контрольная группа | ||
| Исходно |
После лечения |
Исходно |
В конце наблюдения | |
| По Маклакову (10 Г) | 19,4±2,3 |
17,2±2,4*,** |
18,8±2,4 |
19,5±2,5 |
| Истинное ВГД (Ро) | 15,2±2,6 |
13,2±2,5*,** |
15,0±2,6 |
15,7±2,7 |
|
ВГДг |
18,6±3,1 |
15,3±2,9*,** |
17,7±3,2 |
18,5±2,8 |
|
ВГДрк |
19,2±2,7 |
15,1±2,5*,** |
18,5±3,1 |
19,3±2,9 |
*- различие с исходным уровнем достоверно, (p<0,05), ** – различие с контролем в конце наблюдения достоверно (p<0,05).
В таблице 2 представлены результаты определения ВГД различными методами
– тонографически (Ро), по Маклакову и с помощью ORA (ВГДрк и ВГДг) у пациентов основной группы до и через 3 мес. после курса лечения, а также в начале и в конце наблюдения (5 мес.) в группе контроля. Исходно ВГД (независимо от метода его измерения) у пациентов основной и контрольной групп было практически одинаковым (p>0,05). Однако в основной группе, как было отмечено выше, после лечения уровень ВГД статистически значимо снизился и в конце срока наблюдения значения ВГД у пациентов основной и контрольной групп достоверно различались.
Наибольшее снижение ВГД в основной группе отмечено по показателю роговично-компенсированного давления (ВГДрк), что можно расценить как косвенное свидетельство положительного влияния препарата на биомеханические параметры корнеосклеральной капсулы, поскольку именно при определении ВГДрк в наибольшей степени учитываются эти параметры глаукомного глаза.
Значения исследованных биомеханических показателей глаз пациентов основной группы и группы контроля исходно (в начале наблюдения), так же, как и ВГД, практически не различались (таблица 3).
Таблица 3 – Динамика корнеального гистерезиса (КГ) и фактора резистентности роговицы (ФРР) у пациентов основной группы (применявших магнерот) и группы контроля в течение срока наблюдения (М±SD)
| Биомеханический показатель | Основная группа | Контрольная группа | ||
| До лечения | После лечения | В начале наблюдения | В конце наблюдения | |
| КГ, мм рт.ст. | 9,6±1,2 | 10,1±1,3* | 9,7±1,6 | 9,4±1,4 |
| ФРР, мм рт.ст. | 10,1±1,3 | 10,4±1,4 | 10,6±1,7 | 10,1±1,6 |
*- различие с контролем в конце наблюдения достоверно (p<0,05)
В основной группе КГ и ФРР после лечения демонстрируют тенденцию (статистически не значимую) к увеличению. Однако в конце срока наблюдения различия между группами становятся значительными: среднее значение КГ пациентов основной группы статистически достоверно выше соответствующего показателя группы контроля (p<0,05).
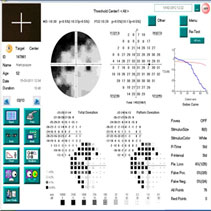
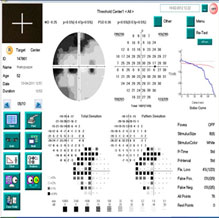
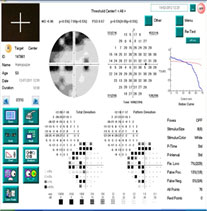
Улучшение биомеханического показателя (КГ) после курса лечения магнеротом (в отличие от группы контроля) косвенно подтверждает комплексное положительное воздействие препарата на метаболические процессы в соединительнотканных структурах глаукомного глаза, что может оказать стабилизирующее влияние на течение глаукомного процесса. После окончания курса лечения отмечено увеличение пороговых значений светочувствительности сетчатки в среднем на 18,4 дБ в верхненазальном квадранте, на 12,5 дБ – в нижненазальном, на 16,2 дБ в верхнетемпоральном и на 12,0 дБ в нижнетемпоральном квадранте (рисунок 6 а, б, в) и достоверное улучшение индекса MD с 7,2±3,1 дБ до 6,4±3,6 дБ (p<0,05).
  |
 |
|
| а) | б) | в) |
| Рисунок 6 – Исследование поля зрения пациентки М. со II «а» стадией ПОУГ: а) до начала приема препарата магнерот; б) через 2 мес. после начала приема препарата магнерот; в) через 3 мес. после окончания приема препарата магнерот | ||
В целом результаты применения препарата показали его благоприятное воздействие на ВГД и биомеханические показатели корнеосклеральной капсулы глаза, а также на структурно-функциональное состояние глаз с ПОУГ. Это свидетельствует о стабилизирующем влиянии препарата магнерот на течение глаукомного процесса и его клинической эффективности в комплексе медикаментозной терапии глаукомной оптической нейропатии.
При изучении взаимоотношений биомеханических свойств оболочек глаза и морфометрических параметров диска зрительного нерва в условиях дозированной вакуум-компрессионной нагрузки выявлено, что биомеханические показатели корнеосклеральной оболочки меняются в зависимости от индуцированного уровня ВГД (таблица 4).
Таблица 4 – Значения ВГД и биомеханических параметров в зависимости от группы обследования до и на фоне вакуум-компрессионных нагрузок
| Группы | Обследование | Показатели, медиана(процентиль Q25-Q75) | |||
|
ВГДг, мм рт.ст. |
ВГДрк, мм рт.ст. |
КГ, мм рт.ст. |
ФРР, мм рт.ст. |
||
|
норма |
до нагрузки |
18,9(16,5-20,6) |
19,1(18,5-20,3) | 11,0(8,6-11,8) | 12,3(9,1-11,6) |
| при нагрузке -60 |
25,7(23,3-27,4) |
27,3(26,4-28,2) | 7,3(4,9-8,1) | 11,7(8,5-11,0) | |
| при нагрузке -80 |
30,3(27,9-32,0) |
34,5(33,9-35,7) | 9,4(7,0-10,2) | 15,8(12,6-15,1) | |
|
Подозрение |
до нагрузки |
20,1(15,8-23,6) |
20,4(18,0-25,8) | 10,4(7,8-10,8) | 11,8(8,4-12,5) |
|
на |
при нагрузке -60 |
27,3(23,0-30,8) |
28,9(26,5-34,3) | 7,3(4,7-7,7) | 10,9(7,5-11,6) |
|
глаукому |
при нагрузке -80 |
33,2(28,9-36,7) |
35,0(32,6-40,4) | 7,2(4,6-7,6) | 12,9(9,5-13,6) |
|
ПОУГ |
до нагрузки |
18,6(15,4-21,5) |
20,3(15,8-21,6) | 9,1(8,2-10,3) | 10,6(9,4-11,6) |
| при нагрузке -60 |
28,4(23,6-29,7) |
31,1(26,6-32,4) | 6,7(5,8-7,8) | 11,1(9,9-12,1) | |
| при нагрузке -80 |
32,1(26,9-35,1) |
35,7(31,2-37,0) | 4,9(4,0-6,1) | 12,1(11-13,1) | |
|
ПОУГ с ПС |
до нагрузки |
14,5(12,1-16,9) |
17,5(14,8-18,7) | 8,3(7,2-9,0) | 7,2(6,6-7,8) |
| при нагрузке -60 |
18,6(15,4-21,7) |
21,1(17,9-24,4) | 8,4(7,8-8,9) | 9,1(8,7-9,5) | |
| при нагрузке -80 |
21,5(18,9-24,4) |
26,7(23,2-29,0) | 5,7(5,3-6,1) | 6,9(6,4-7,3) | |
Исходное значение ВГД у пациентов основных и контрольной групп было практически одинаковым (p>0,05). На фоне нагрузки ВГД во всех группах достоверно увеличивается (p<0,05). В норме при увеличении ВГД на 6,7±0,3 мм рт.ст. значение КГ уменьшаетсяна 3,1±1,4 мм рт.ст., при дальнейшем увеличении ВГД на 11,4±1,5 мм рт.ст. значение КГ, наоборот, увеличиваетсяна 2,4±1,5 мм рт.ст. Анализ структурных изменений зрительного нерва на фоне вакуум- компрессионной нагрузки выявил статистически незначимое увеличение площади диска на 0,23±0,18 мм² (p>0,05), отсутствие изменений параметров экскавации и увеличение площади НРП на 0,31±0,16 мм² (p<0,05) (рисунок 7 а, б).
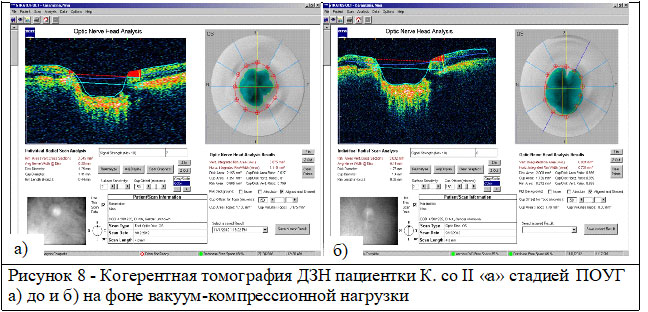
У пациентов с ПОУГ при увеличении ВГД на 7,2±1,2 мм рт.ст. значение КГ уменьшается на 2,4±0,7 мм рт.ст. При увеличении ВГД на 13,2±0,9 мм рт.ст. наблюдалось дальнейшее снижение значений КГ на 4,1±0,8 мм рт.ст. в отличие от контрольной группы без офтальмопатологии. При анализе структурных изменений зрительного нерва на фоне вакуум-компрессионной нагрузки отмечается отсутствие изменений площади ДЗН, увеличение линейных и объемных параметров экскавации и уменьшение площади НРП на 0,49±0,14 мм² (p<0,05) (рисунок 8 а, б).
В группе пациентов с ПОУГ и ПС при увеличении ВГД на 4,9±1,6 мм рт.ст. значение КГ почти не меняется в отличие от группы с ПОУГ.
При дальнейшем увеличении ВГД на 8,1±0,7 мм рт.ст. значение КГ снизилось на 2,7±0,9 мм рт.ст. При анализе структурных изменений зрительного нерва на фоне вакуум-компрессионной нагрузки отмечается незначительное увеличение площади диска на 0,11±0,09 мм² (p>0,05), уменьшение объема и площади экскавации, увеличение площади НРП на 0,29±0,1 мм² (p<0,05).
Таким образом, задний отрезок глаза после укрепления материалом Ксенопласт получает возможность противостоять градиенту давления и механическим деформациям. Однако в результате перераспределения нагрузок растягивающее напряжение увеличивается в переднем отрезке. Этим, возможно, объясняется изначально низкое значение КГ в этой группе и отсутствие динамики показателя при средних нагрузках.
В группе пациентов с подозрением на глаукому отмечаются две совершенно разные картины ответа на механическую нагрузку (рисунок 9 а, б).
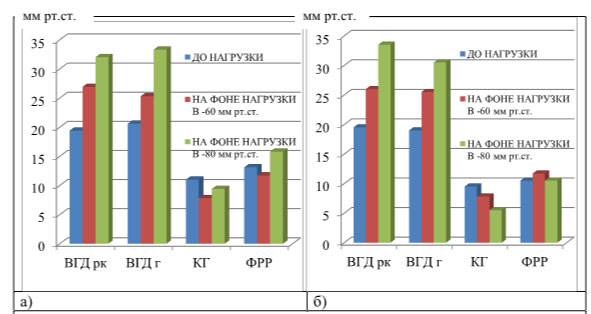
Рисунок 9 – ВГД и биомеханические параметры пациентов с подозрением на глаукому при вакуум-компрессионной нагрузке: а) в подгруппе без подтверждения диагноза и б) в подгруппе с подтверждением диагноза
Это позволило разделить пациентов с подозрением на глаукому на 2 подгруппы, в которых значения КГ при повышении давления достоверно различались (p=0,03, достоверность различий определена по U-критерию Манна- Уитни). В подгруппе пациентов, у которых характер изменения КГ и ДЗН в ходе компрессионной нагрузки был таким же, как у пациентов контрольной группы, мы предполагаем меньшую вероятность развития глаукомы. Подгруппу, в которой КГ изменялся в процессе компрессии так же, как у пациентов с установленным диагнозом глаукома, мы оставили в категории «подозрение на глаукому» для дальнейшего динамического наблюдения. Наиболее интересным фактом, полученным в результате выполнения данного фрагмента работы, является то, что в нормальных глазах при компрессионной нагрузке отмечается растяжение оболочек и за счет этого боковое растяжение ДЗН. Поэтому мы предполагаем, что в случае внутриглазной гипертензии пусковым моментом развития экскавации является увеличение растягивающих напряжений в области ДЗН. В результате растяжения ДЗН уменьшается его механическая устойчивость к градиенту давления между полостью глаза и тканевым блоком зрительного нерва. При участии сопутствующих глаукоме патологических факторов ДЗН со временем теряет способность противостоять градиенту давления, и в исходе развивается глаукомная экскавация. Таким образом, в контрольной группе и в группе с ПОУГ регистрируется противоположная тенденция изменений КГ при увеличении вакуумной нагрузки. ОКТ позволяет оценить изменения ДЗН:при дозированном увеличении ВГД в нормальных глазах экскавация ДЗН статистически значимо на меняется, в глаукомных глазах, по-видимому, за счет повышенной жесткости склеральной оболочки в целом и более слабой в биомеханическом отношении области ДЗН, углубляется.
В результате динамического исследования эффективности гипотензивной терапии аналогами простагландинов по результатам изменений значений корнеального гистерезиса было установлено, что при КГ<8,2 мм рт.ст. существенно повышается риск прогрессирования глаукомного процесса и требуется коррекция гипотензивного режима. В результате назначения гипотензивной терапии аналогами простагландинов значение КГ повысилось до 9,2±0,7 мм рт.ст., что достоверно выше исходных значений, составляющих 7,2±0,4 мм рт.ст (р=0,01). Это подтверждает положительное воздействие аналогов простагландинов на биомеханические свойства корнеосклеральной оболочки глаукомного глаза. Динамическое наблюдение в течение 18 месяцев на фоне инстилляции аналогов простагландинов показало стабильность структурно- функциональных параметров ДЗН, то есть давление цели у этих пациентов было достигнуто. Анализ изменений периметрического индекса MD, характеризующего общее снижение чувствительности, показал уменьшение общей депрессии светочувствительности сетчатки (от 7,0±2,3 дБ до 5,8±2,9 дБ, p<0,05) (рисунок 10).
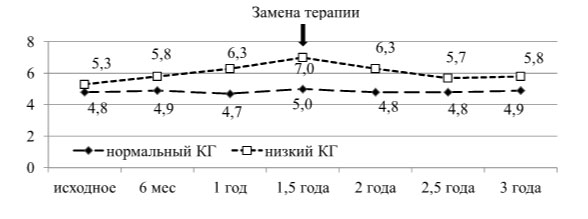
Рисунок 10 – Динамика периметрического индекса MD в группах с разными значениями КГ (медианы) и при замене гипотензивной терапии в группе с низким значением КГ на терапию аналогами простагландинов
Анализ изменений среднестатистического показателя PSD, характеризующего неоднородности в холме поля зрения, показал уменьшение количества относительных дефектов различной глубины (от 7,4±3,1 дБ до 6,5±3,1 дБ, p<0,05). Результаты назначения гипотензивной терапии аналогами простагландинов показали их благоприятное воздействие на биомеханические показатели и структурно-функциональное состояние глаз.
ВЫВОДЫ
- Корнеосклеральная оболочка глаза пациентов при всех стадиях ПОУГ характеризуется (по данным нелинейно-оптической и световой микроскопии) специфическими изменениями коллагенового каркаса (сочетание уплотнения и расщепления пучков и волокон коллагена) и эластических волокон (неравномерность распределения, деструкция, фрагментация, образование клубков, завитков и спиралей), что в целом определяет степень выраженности ремоделирования матрикса склеры в качестве предрасполагающего фактора прогрессирования глаукомы, а также риска ее возникновения.
- Результаты исследования термомеханических показателей (температуры денатурации Тm и энтальпии DHm) свидетельствуют о зависимости уровня поперечной связанности коллагена склеры от возраста и стадии глаукомного процесса. Установлено, что формирование избыточных сшивок, связанное со стадией ПОУГ (изменение Тmи DHm в пределах 1,9-2,70С и 4,0-7,5 Дж/г сухого остатка соответственно), существенно более выражено, чем сшивание коллагеновых комплексов, вызванное естественным процессом старения (изменение Тm и DHm в пределах 0,8-1,00С и 0,3-2,1 Дж/г сухого остатка соответственно).
- Развитие глаукомного поражения в относительно молодом возрасте (50-59 лет) характеризуется более высокой, чем у лиц с глаукомой старших возрастных групп, достоверной прямой корреляционной связью между уровнем сшивок и функционально-структурным состоянием глаукомного глаза, в первую очередь, с периметрическим индексом MD и объемом нейроретинального пояска (R=0,65, р=0,015 и R=0,73, р=0,009, соответственно). При развитии глаукомы в более старшем возрасте глаукомные нарушения происходят на другом метаболическом фоне, при этом дополнительный рост поперечного сшивания коллагена склеры способствует повышению уровня ВГД (R=0,68, р<0,05).
- Результаты исследования термомеханических показателей теноновой капсулы пациентов с ПОУГ свидетельствуют о статистически значимой (р=0,009 по U-критерию Манна-Уитни) зависимости параметров Tm и DHm от стадии развития заболевания (I стадия – Tm=67,3±0,730C и DHm=22,6±1,4 Дж/г; II стадия – Tm=68,2±1,290C и DHm=24,1±1,9 Дж/г; III стадия – Tm=69,1±0,80C и DHm=27,8±2,1 Дж/г сухого остатка соответственно), что позволяет предположить наличие генерализованного поражения соединительнотканных структур глаза при ПОУГ. Полученные результаты показывают, что тенонова капсула, как и склеральная ткань, является ценным объектом для изучения механизма прогрессирования глаукомы.
- Результаты микроэлементного анализа сред и тканей глаукомных глаз (влаги передней камеры, склеры) показали, что по мере прогрессирования глаукомного процесса происходит повышение уровня Fe, Са и снижение содержания Mg, Zn, Cu, Al, Si, B, Li. При этом наиболее существенные, статистически значимые изменения (p<0,05 по сравнению с группой контроля) отмечены в уровне магния и цинка (снижение на 39,6-55,2% и 35,3-43,5% соответственно) и железа (повышение на 41,4-61,9%), что является фактором риска нарушения гидродинамики внутриглазной жидкости и биомеханических свойств склеры.
- Дополнительное (к необходимому медикаментозному гипотензивному режиму) системное применение магнийсодержащего препарата Магнерот у пациентов с ПОУГ сопровождается повышением уровня магния в слезной жидкости (с 0,02±0,01 мг/кг до лечения до 0,28±0,05 мг/кг после него, p=0,0001), снижением уровня ВГД (на 2,0-4,1 мм рт.ст. в зависимости от методики измерения, в большей степени по показателю роговично-компенсированного ВГД, p<0,05), повышением корнеального гистерезиса (на 0,4-0,6 мм рт.ст., p<0,05) и снижением индекса MD (с 7,2±3,1 дБ до 6,4±3,6 дБ, p<0,05), что способствует стабилизации глаукомного процесса.
- Разработан комплексный метод оценки изменений биомеханических показателей корнеосклеральной оболочки глаза и параметров ДЗН при дозированном вакуум-компрессионном подъеме ВГД, который имеет высокую диагностическую значимость у лиц с подозрением на глаукому (чувствительность метода – 93%, специфичность метода – 87%).
- Гипотензивная терапия аналогами простагландинов способствует деградации поперечных сшивок коллагена склеры (Tm=64,9±0,120C по сравнению с Tm=65,4±0,090C при терапии другими гипотензивными препаратами, р<0,05) и благоприятно воздействует на биомеханические и структурно-функциональные показатели глаукомных глаз со статистически значимой положительной динамикой корнеального гистерезиса (на 19,6%, р=0,01), что подтверждает необходимость их назначения при нарушении биомеханических свойств корнеосклеральной оболочки глаза.
- При диагностике, прогнозе течения и определении тактики лечения ПОУГ необходимо учитывать биомеханические показатели корнеосклеральной оболочки глаза.
- Пациентов с ПОУГ относительно молодого возраста следует рассматривать как группу повышенного риска прогрессирования глаукомного поражения, которым требуется назначение препаратов, улучшающих структурно- биомеханические показатели корнеосклеральной капсулы.
- Для коррекции микроэлементного дисбаланса у пациентов с ПОУГ целесообразно системное применение магнийсодержащего препарата Магнерот в качестве дополнения к необходимому местному гипотензивному режиму.
- Для объективной оценки и своевременной диагностики начальных глаукомных изменений и прогрессирования глаукомного процесса целесообразно использовать новый нагрузочный тест с дозированным подъемом ВГД.
- При нарушении биомеханических показателей корнеосклеральной оболочки глаз с ПОУГ целесообразно применение гипотензивной терапии аналогами простагландинов.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Иомдина, Е.Н. Биохимические и термомеханические особенности склеры у больных с разными стадиями первичной открытоугольной глаукомы / Е.Н. Иомдина, Л.Л. Арутюнян, О.А. Киселева, Л.А. Катаргина // Федоровские чтения : тез. докл. VIII науч.-практ. конф. с международ. участием, Москва, 2009. – С. 229-
- Иомдина, Е.Н. Патогенетическое обоснование и экспериментальная разработка новой технологии склероукрепляющего лечения прогрессирующей миопии / Е.Н. Иомдина, Е.П. Тарутта, Н.Ю. Игнатьева, Н.А. Данилов, Л.Л. Арутюнян // II Российский общенациональный офтальмологический форум : сб. тр. науч.-практ. конф. с международ. участием, Москва, – Т. 2. – С. 146-151.
- Иомдина, Е.Н. Изучение местного микроэлементного баланса как фактора, влияющего на биомеханические показатели корнеосклеральной капсулы глаза при первичной открытоугольной глаукоме / Е.Н. Иомдина, О.А. Киселева, И.А. Филатова, М.В. Арефьева, Л.Л. Арутюнян, Е.В. Хорошева // Биомеханика глаза : сб. тр. конф., Москва, – С. 114-118.
- Иомдина, Е.Н. Биомеханика корнеосклеральной оболочки глаза при миопии и глаукоме: сходство и различия / Е.Н. Иомдина, Н.Ю. Игнатьева, Н.А. Данилов, Л.Л. Арутюнян, О.А. Киселева // Биомеханика глаза: сб. тр. конф., Москва, – С. 110-114.
- Иомдина, Е.Н. Взаимосвязь корнеального гистерезиса и структурно- функциональных параметров зрительного нерва при разных стадиях первичной открытоугольной глаукомы / Е.Н. Иомдина, Л.Л. Арутюнян, Л.А. Катаргина, О.А. Киселева, О.М. Филиппова // Российский офтальмологический журнал. – 2009. – № 3. – С. 17-23.
- Iomdina, E. Structural, biomechanical and biochemical peculiarities of the scleral tissue in primary open angle glaucoma (POAG) / E. Iomdina, N. Ignatieva, Arutjunjan, N. Danilov, L. Katargina // Abstracts of SOE 2009, suppl. to European Journ. of Ophthalmology. – 2009. – Vol. 19. – P. 95.
- Arutunyan, Corneal hysteresis and biochemical parameters of scleral tissue at different stages of primary open angle glaucoma (POAG) / L. Arutunyan, E. Iomdina, Ignatieva, N. Danilov, L. Katargina // Glaucoma Congress abstracts book. – Boston, 2009. – P. 77.
- Iomdina, Ocular rigidity and ocular response analyzer / E.Iomdina, L. Arutunyan, N. Ignatieva, N. Danilov // European Association for Vision and Eye Research Conference. EVER 2009. Abstract book. – 2009. – Vol. 87. – P. 36.
- Дячун, А.В. Возрастные изменения показателей биомеханических свойств корнеосклеральной оболочки глаза / А.В. Дячун, О.А. Киселева, А.М. Бессмертный, Е.Н. Иомдина, М.Н. Ефимова, Л.Л. Арутюнян // V Всерос. конф. молодых ученых «Актуальные проблемы офтальмологии» : сб. науч. тр., Москва, – С. 76-78.
- Иомдина, Е.Н. Значимость биомеханических показателей роговицы для прогноза развития первичной открытоугольной глаукомы / Е.Н. Иомдина, О.А. Киселева, Л.Л. Арутюнян // III Российский общенациональный офтальмологический форум : сб. тр. науч.-практ. конф. с международ. участием, посвящ. 110-лет. юбилею МНИИ ГБ им. Гельмгольца, Москва, – С. 312-316.
- Иомдина, Е.Н. Микроэлементный состав влаги передней камеры при первичной открытоугольной глаукоме / Е.Н. Иомдина, О.А. Киселева, М.В. Арефьева, Л.Л. Арутюнян, А.Ю. Волков // III Российский общенациональный офтальмологический форум : сб. тр. науч.-практ. конф. с междунар. участием, посвящ. 110-лет. юбилею МНИИ ГБ им. Гельмгольца, Москва, – Т. 1. – С. 317-322.
- Дячун, А.В. Изменение биомеханических показателей корнеосклеральной оболочки глаза у лиц старших возрастных групп / А.В. Дячун, О.А. Киселева, Е.Н. Иомдина, М.Н. Ефимова, А.М. Бессмертный, Л.Л. Арутюнян // Вестник Оренбургского государственного университета. – 2010. – № 12. – С. 54-56.
- Киселева, О.А. Возможная роль дисбаланса макро- и микроэлементов в патогенезе первичной открытоугольной глаукомы / О.А. Киселева, Е.Н. Иомдина, Л.Л. Арутюнян, М.В. Арефьева // Глаукома: теории, тенденции, технологии. НРТ клуб Россия-2010: сб. науч. ст. VII междунар. конф., Москва, – С. 152-163.
- Данилов, Н.А. Физико-химический анализ склеры глаукоматозных глаз / Н.А. Данилов, Н.Ю. Игнатьева, Е.Н. Иомдина, Л.Л. Арутюнян, Т.Е. Гроховская, В.В. Лунин // Биофизика. – – Т. 56, № 3. – С. 520-526.
- Danilov, A. Sclera of the Glaucomatous Eye: Physicochemical Analysis / N.A. Danilov, N.Yu. Ignatieva, E.N. Iomdina, L.L. Arutyunyan, T.E. Grokhovskaya, V.V. Lunin // Biophysics. – 2011. – Vol.56, № 3. – P. 490-495.
- Иомдина, Е.Н. Биохимические и cтруктурно-биомеханические особенности матрикса склеры человека при первичной открытоугольной глаукоме / Е.Н. Иомдина, Н.Ю. Игнатьева, Н.А. Данилов, Л.Л. Арутюнян, О.А. Киселева, Л.А. Назаренко // Вестник офтальмологии. – – № 6. – С. 10-14.
- Иомдина, Е.Н. Микроэлементный дисбаланс в патогенезе первичной открытоугольной глаукомы / Е.Н. Иомдина, О.А. Киселева, Л.Л. Арутюнян, М.В. Арефьева // Российский офтальмологический журнал. – – Т. 5, № 1. – С. 104-108.
- Иомдина, Е.Н. Нарушение баланса магния в тканях глаукомного глаза как обоснование терапии магнийсодержащим препаратом / Е.Н. Иомдина, О.А. Киселева, Л.В. Василенкова, М.В. Арефьева, Л.Л. Арутюнян // Российская глаукомная школа. V юбилейная конференция «Глаукома: теория и практика» : сб. науч. тр., Санкт-Петербург, – С. 112-114.
- Киселева, О.А. Применение магний-содержащего препарата для лечения больных с первичной открытоугольной глаукомой (ПОУГ) / О.А. Киселева, Е.Н. Иомдина, Л.В. Василенкова, М.В. Арефьева, Л.Л. Арутюнян // Фарматека. – – №3. – С. 91-95.
- Иомдина, Е.Н. Лекарственная коррекция дефицита магния в лечении ПОУГ
- Е.Н. Иомдина, О.А. Киселева, Л.В. Василенкова, Л.Л. Арутюнян, Е.П. Кантаржи // VII междунар. науч. конф. «Пролиферативный синдром в офтальмологии» : сб. науч. тр., Москва, 2012. – С. 110-116.
- Иомдина, Е.Н. Влияние коррекции уровня магния на внутриглазное давление и биомеханические показатели корнеосклеральной капсулы больных с первичной открытоугольной глаукомой / Е.Н. Иомдина, О.А. Киселева, Л.В. Василенкова, М.В. Арефьева, Л.Л. Арутюнян, И.М. Курылева, Е.П. Кантаржи // Российский офтальмологический журнал. – – Т. 5, № 4. – С. 27-32.
- Анисимов, С.И. Изменение биомеханических свойств глаза и параметров диска зрительного нерва в условиях дозированного подъема внутриглазного давления / C.И. Анисимов, С.Ю. Анисимова, Л.Л. Арутюнян, Н.П. Чигованина, Т.С. Любимова // Федоровские чтения : сб. тез. X Всерос. науч.-практ. конф. с международ. участием, / под ред. Б.Э. Малюгина. – Москва : Офтальмология, – С. 87.
- Arutunyan, L.L. Magnesium Balance Disorders in POAG: a Motivation for Treatment with Magnesium-Containing Medication / L. Arutyunyan, E.N. Iomdina,
O.A. Kiseleva, L.V. Vasilenkova, M.V. Arefyeva // 10th European Glaucoma Society Congress. – Copenhagen, 2012. – № 11. – P. 59.
- Анисимова, C.Ю. Многоуровневый анализ соединительной ткани при первичной открытоугольной глаукоме / C.Ю. Анисимова, Е.Н. Иомдина, Л.Л. Арутюнян, С.И. Анисимов, Н.Ю. Игнатьева // Российская глаукомная школа. VI конференция «Глаукома: теория и практика» : сб. науч. тр., Санкт-Петербург, – С. 26-32.
- Арутюнян, Л.Л. Многоуровневый анализ склеральной ткани при первичной открытоугольной глаукоме / Л.Л. Арутюнян, Е.Н. Иомдина, Н.Ю. Игнатьева, С.И. Анисимов // VI Российский общенациональный офтальмологический форум : сб. науч. тр. науч.-практ. конф. с междунар. участием, Москва, 2013 /под ред. В.В. Нероева. – Москва : Апрель, – Т. 2. – С. 384-388.
- Arutunyan, L.L.Multilevel Analysis of Scleral Tissue of Eyes with Primary Open-Angle Glaucoma (POAG) / L. Arutunyan, E.N. Iomdina, N.Yu. Ignatieva // World glaucoma congress. Abstract Book. –Vancuver, 2013. – P. 193-194.
- Анисимов, С.И. Изменение биомеханических свойств глаза и морфометрических параметров диска зрительного нерва в условиях дозированной вакуум-компрессионной нагрузки / С.И. Анисимов, С.Ю. Анисимова, Л.Л. Арутюнян, Н.П. Чигованина // Глаукома. – – № 2. – С. 30-37.
- Анисимова, С.Ю. Динамика корреляционных связей морфологических, биомеханических и функциональных показателей глаукомных глаз в ходе медикаментозного и хирургического лечения / С.Ю. Анисимова, С.И. Анисимов, Н.С. Анисимова, Л.Л. Арутюнян // Глаукома. – – № 3. – Ч. 2. – С. 96-102.
- Анисимов, С.И. Сравнительный анализ биомеханических свойств глаза и морфометрических параметров диска зрительного нерва в условиях дозированной вакуум-компрессионной нагрузки при первичной открытоугольной глаукоме / С.И. Анисимов, C.Ю. Анисимова, Л.Л. Арутюнян, Н.П. Чигованина // Российский офтальмологический журнал. –2013. – № – С. 9-15.
- Арутюнян, Л.Л. Гипотензивная эффективность ингибитора карбоангидразы дорзопта при послеоперационной офтальмогипертензии у пациентов с катарактой и первичной открытоугольной глаукомой / Л.Л. Арутюнян, С.И. Анисимов, C.Ю. Анисимова, К.М. Полякова // Российский офтальмологический журнал. –2013. – Т. 6, № 4. – С. 4-8.
- Арутюнян, Л.Л. Комплексный анализ соединительной ткани при первичной открытоугольной глаукоме / Л.Л. Арутюнян, C.Ю. Анисимова, Е.Н. Иомдина, С.И. Анисимов, Н.Ю. Игнатьева // Федоровские чтения : сб. тез. XI Всерос. науч.-практ. конф. с международ. участием, / под ред. Б.Э. Малюгина. – Москва: Офтальмология, 2013. – С.
- Anisimova, Clinical results of perineural scleroplasty by xenocollagen material in the surgical treatment of glaucoma / S. Anisimova, S. Anisimov, N. Chigovanina, L. Arutyunyan, N. Anisimova // World glaucoma congress. Abstract book. – Vancuver, 2013. – P. 542-543.
- Anisimov, I. The research of eye biomechanical properties and optic disk parameters in cases of glaucoma suspicions / I. Anisimov, Arutyunyan, S. Anisimova // World glaucoma congress. Abstract book. –Vancuver, 2013. – P. 192.
- Arutyunyan, The new biomechanical coefficient in the study of glaucoma / L. Arutyunyan, S. Anisimova // XXXI Congress of the ESCRSN 5-9 october 2013. – Amsterdam, 2013. – P. 109.
- Arutyunyan, L. Using Multiphoton Microscopy in the Study of Collagen and Elastic Fibers of Human Glaucomatous Sclera / Arutyunyan, E. Iomdina, N. Ignatieva, A. Shekhter, E. Sergeeva, O. Zakharkina, S. Anisimov // 11th European Glaucoma Society Congress. – Nice, 2014. – P. 58.
- Арутюнян, Л.Л. Структурно-функциональные и биомеханические показатели пациентов с первичной открытоугольной глаукомой при адъювантной терапии 0,15% бримонидином / Л.Л. Арутюнян // Национальный журнал
«Глаукома». – 2014. – Т. 13, № 1. – С. 28-34.
- Арутюнян, Л.Л. Динамика структурно-функциональных показателей пациентов с ПОУГ на фоне применения 0,15% бримонидина / Л.Л. Арутюнян, С.Ю. Анисимова // ХII Всероссийская школа офтальмолога. – Москва, 2014. – С. 227-230.
- Арутюнян, Л.Л. Эффективность применения фиксированной комбинации Дуопрост при первичной открытоугольной глаукоме / Л.Л. Арутюнян // Российский офтальмологический журнал. – 2014. – Т. 7, № 3. – С. 86-89.
- Анисимова, С.Ю. Непроникающая глубокая склерэктомия и факоэмульсификация с фемтосопровождением у больных с катарактой и глаукомой / С.Ю. Анисимова, С.И. Анисимов, Л.Л. Арутюнян, И.В. Новак, Н.П. Чигованина, Л.В. Загребельная, К.М. Полякова // Edition of the National Academy Glaucoma Foundation. – Sofia, Bulgaria, – Vol. 4, Issue 2. – P. 67-71.
- Анисимов, С.И. Биомеханические свойства глаза и морфометрические параметры диска зрительного нерва в условиях дозированной вакуум- компрессионной нагрузки при первичной открытоугольной глаукоме / С.И. Анисимов, С.Ю. Анисимова, Л.Л. Арутюнян // Edition of the National Academy Glaucoma Foundation. – Sofia, Bulgaria, – Vol. 4, Issue 2. – P. 59-64.
- Анисимова, С.Ю. Комбинированная непроникающая глубокая склерэктомия и факоэмульсификация с фемтосопровождением у больных с катарактой и глаукомой / С.Ю. Анисимова, С.И. Анисимов, И.В. Новак, Л.Л. Арутюнян, Н.П. Чигованина, Л.В. Загребельная, К.М. Полякова // Национальный журнал глаукома. – 2014. – Т. 13, № – С. 63-69.
- Анисимова, С.Ю. Корреляционный анализ функциональных и структурных параметров пациентов с ПОУГ / С.Ю. Анисимова, Л.Л. Арутюнян, Е.С. Шебеко
// Федоровские чтения: сб. тез. XIIВсерос. науч.-практ. конф. с международ. участием, / под ред. Б.Э. Малюгина. – Москва : Офтальмология, 2014. – С. 108.
- Арутюнян, Л.Л. Структурно-функциональные и биохимические показатели пациентов с первичной открытоугольной глаукомой при хирургической и медикаментозной нейропротекции / Л.Л. Арутюнян, C.Ю. Анисимова, С.И. Анисимов // Инновационные технологии в офтальмологической практике регионов : сб. тр. конф. – Астрахань, – С. 71-81.
- Иомдина, Е.Н. Изучение коллагеновых и эластических структур склеры глаз при глаукоме с помощью нелинейно-оптической (мультифотонной) микроскопии и гистологии / Е.Н. Иомдина, Н.Ю. Игнатьева, Л.Л. Арутюнян, А.Б. Шехтер, Е.А. Сергеева, О.Л. Захаркина, С.И. Анисимов // Российский офтальмологический журнал. – 2015. – Т. 8, № 1. – С. 50-58.
- Дурягина, Г.А. Особенности диагностики и развития глаукомы у пациентов после перенесенной передней радиальной кератотомии / Г.А. Дурягина, С.И. Анисимов, Л.Л. Арутюнян, С.Ю. Анисимова // X Всерос. науч. конф. молодых ученых с междунар. участием «Актуальные проблемы офтальмологии» : сб. науч. тр., Москва, 2015. – С.
- Иомдина, Е.Н. Изучение уровня поперечной связанности коллагена склеры глаукомных глаз в возрастном аспекте / Е.Н. Иомдина, Л.Л. Арутюнян, Н.Ю. Игнатьева // VIII Российский общенациональный офтальмологический форум : сб. науч. тр. науч.-практ. конф. с междунар. участием / под ред. В.В. Нероева. – Москва, 2015. – Т. 1. – С. 76-85.
- Арутюнян, Л.Л. Изучение связи уровня поперечной связанности коллагена склеры глаукомных глаз с их клинико-функциональными параметрами / Л.Л. Арутюнян // VIII Российский общенациональный офтальмологический форум : сб. науч. тр. науч.-практ. конф. с междунар. участием / под ред. В.В. Нероева. – Москва, – Т. 2. – С. 774-783.
- Арутюнян Л.Л. Влияние гипотензивной терапии на морфофункциональные и биомеханические параметры глаза / Л.Л. Арутюнян // Вестник офтальмологии.
– 2015. – № 5. – С. 61-67.
- Арутюнян Л.Л. Взаимоотношения структурно-функциональных параметров и уровня поперечной связанности коллагена склеры глаукомных глаз / Л.Л. Арутюнян // Национальный журнал «Глаукома». – 2015. – Т. 14, № 4. – С. 5-11.
- Иомдина Е.Н. Сравнительное изучение возрастных особенностей уровня поперечной связанности коллагена склеры пациентов с различными стадиями первичной открытоугольной глаукомы / Е.Н. Иомдина, Л.Л. Арутюнян, Н.Ю. Игнатьева // Российский офтальмологический журнал. – – Т. 9, № 1. – С. 30-35
- Иомдина Е.Н. Структурно-биомеханические свойства теноновой капсулы глаз пациентов с первичной открытоугольной глаукомой / Е.Н. Иомдина, Л.Л. Арутюнян, Н.Ю. Игнатьева // Глаукома: теории, тенденции, технологии. Сборник научных статей XIII международного конгресса. М., 2015, С. 101-103.
СПИСОК СОКРАЩЕНИЙ
ВГД – внутриглазное давление ВГДг – ВГД по Гольдману
ВГДрк – роговично-компенсированное ВГД
ГВГ – генерация второй гармоники
ГОН – глаукомная оптическая нейропатия ДЗН – диск зрительного нерва
ДСК – дифференциальная сканирующая калориметрия ДФФ – двухфотонная флуоресценция
КГ – корнеальный гистерезис
НГСЭ – непроникающая глубокая склерэктомия НЛОМ – нелинейная оптическая микроскопия НРП – нейроретинальный поясок
ОКТ – оптический когерентный томограф ПОУГ – первичная открытоугольная глаукома ПС – периневральнаясклеропластика
ФРР – фактор резистентности роговицы ЦТР – центральная толщина роговицы
M±SD – M – среднеарифметическое значение, SD – стандартное отклонение MD – mean deviation – среднее отклонение
ORA –Ocular Response Analyzer – анализатор биомеханических свойств глаза
PSD – pattern standard deviation − стандартное отклонение паттерна или вариабельность дефектов
Q25-Q75 – распределение параметра между 25 и 75 процентилями
U – критерий Манна-Уитни – сравнение независимых выборок при неравномерном распределении параметра
Тm – температура денатурации
DHm – энтальпия денатурации
Источник:
medprofedu.ru›upload-files/ds03/ArAvt.pdf

