Warning: Use of undefined constant name - assumed 'name' (this will throw an Error in a future version of PHP) in /home/art6125750/xn--80afieejgglfpb6a5a4k.xn--p1ai/docs/wp-content/themes/twentyseventeen-child/functions.php on line 47
В Канаде совершен научный прорыв, позволяющий эффективнее тормозить развитие глаукомы
Инсулин – ведущий участник восстановления морфологии дендритов, улучшения функции и выживания поврежденных нейронов сетчатки
Уважаемые посетители сайта!
Мы обычно стараемся донести до читателя смысл и перспективы изысканий в ведущих научных центрах мира по проблемам зрения. Исследование, о котором говорится здесь, революционное по своей сути и поможет появлению новых стандартов работы с больными глаукомой. Время покажет, так ли это.
Выражаю глубокую признательность координатору онлайн-проекта «Жизнь с глаукомой. Стратегии адаптации» офтальмохирургу Армену Андраниковичу Гинояну за информацию о видеоанонсе профессора Адрианы Ди Поло.
Материал трудный; он побуждает к общению c книгами по биологии и «дергая за ниточки любознательности».
Н. Флорова, главный редактор проекта
Историческая справка
 В канадском Лондоне (провинция Онтарио) находится «место рождения инсулина», дом-музей врача Фредерика Гранта Бантинга, лауреата Нобелевской премии по медицине 1923 года за открытие инсулина (совместно с Дж. Маклеодом).
В канадском Лондоне (провинция Онтарио) находится «место рождения инсулина», дом-музей врача Фредерика Гранта Бантинга, лауреата Нобелевской премии по медицине 1923 года за открытие инсулина (совместно с Дж. Маклеодом).
На территории музея королева Великобритании Елизавета в 1989 году зажгла «Пламя Надежды» (Flame of Hope), символизирующее надежды человечества на радикальный способ лечения сахарного диабета.
Наверное, есть некий высший смысл в том, что именно в Канаде открыты новые возможности применения инсулина, дающие надежду и больным глаукомой.
Jessica Agostinone, Luis Alarcon-Martinez, Clare Gamlin, Wan-Qing Yu, Rachel O. L. Wong , Adriana Di Polo
Insulin signalling promotes dendrite and synapse regeneration and restores circuit function after axonal injury
Инсулин, как природная сигнальная система, способствует регенерации дендритов и синапсов и восстанавливает функцию клеточного контура после травмы аксона
Электронный журнал BRAIN 2018: 141; 1963–1980 doi :10.1093/ brain / awy 142
https :// academic . oup . com / brain / article /141/7/1963/5039589
 На форуме GlaucomaResearchFoundation в июле 2018 года было заявлено, что группа нейробиологов и клиницистов, возглавляемая профессором университета Монреаля Adriana Di Polo (Канада), совершила крупный прорыв в лечении глаукомы. Исследование, проведенное при поддержке гранта Glaucoma Research Foundation Shaffer Grant, может быть также применено к другим нейродегенеративным расстройствам, включая болезнь Альцгеймера. Суть открытия в том, что использование инсулина может привести к восстановлению зрения у больных глаукомой.
На форуме GlaucomaResearchFoundation в июле 2018 года было заявлено, что группа нейробиологов и клиницистов, возглавляемая профессором университета Монреаля Adriana Di Polo (Канада), совершила крупный прорыв в лечении глаукомы. Исследование, проведенное при поддержке гранта Glaucoma Research Foundation Shaffer Grant, может быть также применено к другим нейродегенеративным расстройствам, включая болезнь Альцгеймера. Суть открытия в том, что использование инсулина может привести к восстановлению зрения у больных глаукомой.

Department of Neuroscience, University of Montreal, Montreal, Quebec H2X 0A9, Canada; University of Montreal Hospital Research Center (CR-CHUM), University of Montreal, Montreal, Quebec H2X 0A9, Canada; Department of Biological Structure, University of Washington, 1959 NE Pacific Street, Seattle, Washington, 98195, USA
В аннотации статьи сообщается, что патология дендритов и дизассемблирование (демонтаж) синапсов являются критическими признаками хронических нейродегенеративных заболеваний. Несмотря на это, способность поврежденных нейронов регенерировать дендриты в значительной степени игнорировалась предшествующими исследованиями. Авторы показали, что при повреждении аксонов в ганглиях сетчатки еще до гибели нейронов происходят быстрое восстановление дендритов и массивные потери синапсов.
Человеческий рекомбинантный инсулин в виде глазных капель или системно после сужения объема дендритных структур (деревьев), но до стадии потери клеток, способствует устойчивой регенерации дендритов и успешному воссоединению с пресинаптическими мишенями. Инсулин-опосредованная регенерация возбуждающих постсинаптических участков на дендритных процессах ганглиозных клеток сетчатки увеличивала выживаемость нейронов и разблокировала реакцию сетчатки на свет. Кроме того, мы показываем, что индуцированное аксотомией уменьшение объема дендритов вызывало существенную потерю активности мишени рапамицина млекопитающих (mTOR) (внутриклеточных сигнальных комплексов, регулирующих рост и выживание) исключительно в ганглиозных клетках сетчатки, и что инсулин полностью изменял этот ответ. Моделирование потери функции показало, что инсулинозависимая активация комплекса mTOR 1 (mTORC1) необходима для нового дендритного ветвления для восстановления сложности дерева, в то время как комплекс 2 (mTORC2) управляет расширением дендритного процесса, восстанавливая тем самым площадь поля.
Показано, что нейронам центральной нервной системы млекопитающих присуща природная способность регенерировать дендриты и синапсы после травмы, дано научное обоснование использованию инсулина в про-регенеративной терапии трудноизлечимых нейродегенеративных заболеваний, включая глаукому.
Ниже следует перевод фрагментов текста статьи (открытого доступа с разрешением на использование материалов в некоммерческих целях). В конце дан терминологический словарь, который можно дополнить самостоятельно.
Интересующиеся данным исследованием могут прочитать полный текст в оригинале здесь. Для повышения адаптивности текста в переводе опущены ссылки на литературные источники и аббревиатуры биохимических маркеров.
Введение
Дендриты представляют собой высокоспециализированные отростки нервной клетки, от целостности которых зависит, насколько благополучно в нейронных цепях идут передача, доставка и обработка информации. Сокращение объема сети дендритов (ретракция) и демонтаж синапсов (дезассемблирование) – это ранние признаки патологии в ряду психических и нейродегенеративных расстройств. Патология дендрита происходит еще до потери аксона (тела самой нервной клетки) и означает существенную утрату ее функции. Основной вопрос заключается в том, способны ли дендриты зрелых поврежденных нейронов восстановиться, и могут ли восстановиться их связи с пресинаптическими мишенями после разрушения.
У млекопитающих посттравматическая способность нейронов центральной нервной системы к восстановлению крайне ограничена. Хотя регенерацией аксонов занимались многие исследователи, способность нейронов млекопитающих отрастить дендриты и восстановить функциональную активность практически не изучена. Вместе с тем, это ключевая проблема, так как патологическое «отсоединение» от пресинаптических мишеней приводит к постоянным функциональным нарушениям и провоцирует гибель нейронов.
Отклоняющаяся от нормальной или неэффективная регуляторная функция инсулина даже в отсутствие диабета может быть связана с нейродегенерацией при расстройствах, для которых характерна патология дендритов (при болезнях Альцгеймера, Паркинсона), и при глаукоме.
Традиционно рассматриваемый исключительно как периферически действующий гормон, инсулин преодолевает гематоэнцефалический барьер и может влиять на ряд физиологических процессов мозга, включая выживание нейронов, нейротрансмиссию и когнитивную деятельность.
Предположительно, регуляторная функция инсулина может быть направлена и на изменение расстройства; однако его роль в ответной реакции уязвимых нейронов пока что мало изучена.
Можно упомянуть, что интраназальное (через нос) введение инсулина улучшает память и внимание у пациентов с болезнью Альцгеймера, однако механизм этого эффекта в настоящее время также неизвестен.
Со своей стороны, авторы статьи задались вопросом: способствует ли участие инсулина регенерации дендритов и восстановлению функциональных связей, и если да, то какие внутриклеточные пути регулируют этот ответ?
Чтобы ответить на это, авторы выбрали в качестве объекта ретинальные ганглиозные клетки (retinal ganglion cells или RGCs) ─ нейроны центральной нервной системы, передающие визуальную информацию от сетчатки к мозгу через аксоны зрительного нерва.
Избирательная гибель RGCs представляет собой решающий момент в патофизиологии глаукомы и главную причину необратимой слепоты.
Быстрое снижение объема дендритов RGCs представляет собой одно из наиболее ранних проявлений патологических изменений при глаукоме, как показала Ди Поло в соавторстве с Agostinone в 2015 г.
Известно, что обильные быстро реагирующие рецепторы инсулина присутствуют в зрелых клетках RGCs, и нарушение регуляторной функции этого гормона в нейронах подавляет разрастание отростков нервных клеток (нейритов).
Инсулин также опосредованно активирует типичный для млекопитающих двухкомпонентный белковый комплекс TORC (TORC1 и TORC2).
Основу мультипротеинового комплекса mTORC1 составляют mTOR, Raptor (белковый регулятор, связанный с mTOR, а также mLST8 (несовместимый с жизнью, или летальный фактор) с протеином Sec13 protein 8.
Основу мультипротеинового комплекса mTORC2 составляет вместо Raptor – Rictor (нечувствительный к рапамицину компонент mTOR), обозначаемый как RICTOR, – полностью чужеродный белок с аналогичной функцией.
Полученные данные свидетельствуют, что инсулин, введенный в тот момент когда происходит заметное снижение объема разветвления дендритов, (дендритного дерева), способствует превосходной регенерации дендритов.
 Авторы показали, что активация как mTORC1, так и mTORC2 необходима для успешной регенерации дендритов с помощью инсулина. Кроме того, лечение инсулином приводит к поразительной регенерации пре- и пост- синаптических компонентов, с выраженным увеличением возбуждающих постсинаптических сайтов в трех различных по устойчивости к возбуждению типах RGCs.
Авторы показали, что активация как mTORC1, так и mTORC2 необходима для успешной регенерации дендритов с помощью инсулина. Кроме того, лечение инсулином приводит к поразительной регенерации пре- и пост- синаптических компонентов, с выраженным увеличением возбуждающих постсинаптических сайтов в трех различных по устойчивости к возбуждению типах RGCs.
Важно, что инсулин способствовал устойчивому выживанию нейронов и восстанавливал реакцию сетчатки на свет.
В совокупности можно считать, что нейроны центральной нервной системы млекопитающих способны регенерировать поврежденные дендриты и синапсы и идентифицировать регуляторную систему инсулин-mTORC1/2, как инструмент восстановления дендритных разветвлений и функциональной активности нейронной цепи.
Материалы и методы
Экспериментальные животные и условия опытов
Все процедуры на животных проводились с одобрения Комитета по уходу за животными Медицинского центра Университета Монреаля (CRCHUM), в соответствии с рекомендациями Канадского совета по уходу за животными.
Хирургические процедуры были проведены на мышах в возрасте 3-4 месяцев: либо из лабораторной линии B6.Cg.Tg [Thy1-YFPH] 2Jrs / J мыши (лаборатория Джексона) либо на животных дикого типа из одного помета. Содержание мышей: 12-часовое освещение со сменой на 12-часовое затемнение, со средним уровнем освещения в клетке 10 лк.
Инсулин и иные препараты в опыте
Использован стерильный человеческий рекомбинантный инсулин, разведенный в стерильной среде без эндотоксинов в расчете 15–30 Е/кг веса животного/день: либо PBS, Sigma-Aldrich, либо Humulin-R U100, Eli Лилли. Инсулин вводили ежедневными внутрибрюшинными инъекциями или как глазные капли в соответствии с режимом, описанным на рис. 1 F.
Для оптимизации проникновения инсулина к нему добавляли усилитель проницаемости, не дававший какой-либо аллергической реакции или побочных эффектов.
Рекомбинантный FITC-меченый инсулин использовали для изучения доступа инсулина к сетчатке.
Комплексный ингибитор mTORC1/2 KU0063794 в расчете 8 мг/кг/день
вводили отдельно или в комбинации с инсулином.
Рапамицин 6мг/кг/день вводился внутрибрюшинной инъекцией.
Аксотомия зрительного нерва
Травма аксона была вызвана полным разрезом (аксотомия) зрительного нерва, чтобы вызвать быструю и стереотипную потерю RGCs. Зрительный нерв перерезали на расстоянии 0,5-1,0 мм от диска.
Были предприняты меры, чтобы не повредить центральную артерию сетчатки; до и после процедуры для проверки функционального состояния сетчатки обычно проводилось обследование глазного дна.
Аксотомия может вызвать изменения в другом глазу, поэтому все контрольные глаза принадлежали животным вне острого опыта.
Проведены следующие исследования
(детали в тексте, термины в словаре; приведено для того чтобы показать глубину разработки проблемы):
- иммуногистохимия сетчатки на криосрезах сетчатки удаленных глаз;
- интравитреальная доставка с изменениями последовательностей в структуре РНК (для получения образцов под общим наркозом прокалывали склеру и сетчатку, проникая в стекловидное тело и избегая тем самым повреждения радужной оболочки или хрусталика);
- вестерн-блоттинг (анализ на специфичные белки в лизированных препаратах целой сетчатки, перенесенных на полиакриламидные гели);
- анализ синаптических маркеров в срезах сетчатки (глаза обезглавленных мышей с проколотой роговицей подвергали обработке для приготовления криосрезов, которые затем инкубировали с растворами антител);
- анализ плотности постсинаптического пространства (морфологическую структуру дендритных разветвлений реконструировали после нанесения распыленного золота с помощью генной пушки на поверхность сетчатки глаз убитых животных и последующего суточного выдерживания целых глаз в камере при 32 градусах Цельсия и увлажнении при насыщении кислородом);
- электроретинография (после адаптации в темноте при красном свете. Активный электрод помещался на роговицу, электрод сравнения за ушами, а заземляющий на хвосте);
- количественная оценка выживаемости нейронов (изолированные препараты сетчатки после выдерживания при 4° С в смеси 10% козьей сыворотки, 2% бычьего сывороточного альбумина, 0,5% TritonTM X-100 в PBS инкубированы со специфичным для RGC маркером RBPMS в течение 5 дней при 4° С и затем просматривали на Zeiss Axio Observer. RGC с меткой RBPMS подсчитывали в поле зрения на расстоянии 0,25, 0,625 и 1 мм от диска зрительного нерва).
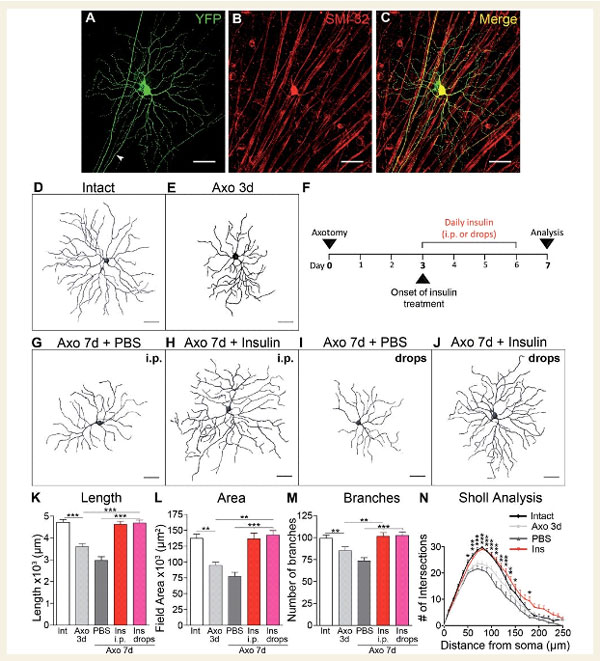
Рис.1. Инсулин способствует регенерации дендритов зрелых RGCs после травматизации аксонов
A, В, C : RGCs, или ретинальные ганглиозные клетки, с четко видимым аксоном (на него указывает наконечник стрелки), были выбраны для визуализации дендритных деревьев и трехмерной реконструкции.
D, E : Через три дня после аксотомии (повреждения), RGCs имели заметно меньшие и более простые дендритные деревья по сравнению с интактными неповрежденными нейронами.
F : Человеческий рекомбинантный инсулин (или носитель, PBS) вводили ежедневно в течение четырех дней внутрибрюшинной инъекцией или местно (глазными каплями), начиная с третьего дня после аксотомии, времени, когда уже наблюдается существенная ретракция дендритов.
G, J : Анализ дендритной кроны RGC проводился через 7 дней после травмы (4 дня лечения инсулином).
K, M, N : Количественный анализ параметров дендритов показал, что нейроны, обработанные инсулином, имели более длинные дендриты и заметно большие и более сложные деревья, чем контрольные, обработанные носителем (инсулин: красный, глазные капли инсулина: розовый, PBS: темно-серый, контроль – белый).
Илл. к статье
Jessica Agostinone, Luis Alarcon-Martinez, Clare Gamlin, Wan-Qing Yu, Rachel O. L. Wong , Adriana Di Polo, 2018. https :// academic . oup . com / brain / article /141/7/1963/5039589
Результаты (фрагменты)
Инсулин способствует устойчивой регенерации дендритов зрелых RGCs после повреждения аксонов
Чтобы понять, обладают ли зрелые нейроны способностью регенерировать дендриты, мы использовали хорошо зарекомендовавшую себя модель острого опыта – пересечения зрительного нерва для избирательного повреждения аксонов RGC у трансгенных мышей определенного типа. Отмечено, что через 3 дня после аксотомии дендриты заметно сократились по сравнению с неповрежденными интактными нейронами (рис. 1, D и E). Общая длина дендритов и общая площадь дендритов снизилась соответственно на 23% и 31% по сравнению с контролем. Дендритная «усадка» произошла до потери RGC сомы или аксона, которая начинается через 5 дней после повреждения.
Основываясь на выраженной индуцированной травмой ретракции дендритов, наблюдаемой через 3 дня, мы начали введение человеческого рекомбинантного инсулина или носителя (PBS) в этот момент времени и аналогично проанализировали длину, площадь и сложность дендритов через 4 дня (то есть, спустя 7 дней после поражения). Режим введения инсулина показан на рис.1, F, где указана суточная доза инсулина в течение 4 дней, начиная с 3-го дня после аксотомии, был одинаков на протяжении всего исследования. Инсулин доставлялся путем внутрибрюшинной инъекции, что приводило к легкому и кратковременному снижению уровня глюкозы в крови с последующим быстрым восстановлением, или местно в виде глазных капель без заметных изменений гликемии. Через 7 дней после аксотомии RGCs, обработанные носителем, имели сжатые дендритные деревья со значительно меньшим количеством ветвей (Рис. 1, G и I). Введение же инсулина, независимо от пути введения, способствовало надежной регенерации дендритов RGC и восстановлению длины процесса, площади и сложности дерева (рис. 1, H и J).
Например, количественный анализ дендритных параметров после лечения инсулином продемонстрировал увеличение длины на 36% и площади дерева на 43% по сравнению с нейронами, обработанными носителем (рис. 1,K и L). Инсулин также увеличил количество дендритных ветвей по сравнению с контрольными нейронами (рис. 1, M) и способствовал глобальному росту числа пересечений ветвей на всех расстояниях от сомы, что свидетельствует о росте сложности структуры кроны дерева. В целом, инсулин восстановил все дендритные параметры (крону дерева и ее сложность) до значений в обычных неповрежденных сетчатках.
Следует подчеркнуть, что введение инсулина двумя способами приводит к аналогичным регенеративным результатам. Авторы также исключают влияние гликемических изменений при введении инсулина на морфологию дендритов.
Введение FITC-меченного рекомбинантного инсулина подтвердило, что инсулин эффективно достигал клеток сетчатки.
В совокупности эти результаты демонстрируют, что инсулин, введенный после значительного сокращения дендритов, поразительно способствует их регенерации; это позволяет считать, что зрелые нейроны центральной нервной системы обладают способностью регенерировать дендриты после травмы.
Инсулин восстанавливает глутаматэргические постсинаптические участки в поврежденных нейронах

Возбуждающие воздействия на RGCs происходят в ленточном синапсе, специализированной структуре, которая обеспечивает быструю и устойчивую нейротрансмиссию, необходимую для зрения. Авторы поставили перед собой задачу выяснить, восстанавливает ли инсулин глутаматергические синапсы при регенерированных дендритных процессах.
С этой целью авторы исследовали изменения в транспортере глутамата, пресинаптическом белке в синапсах биполярной ленты, и в белке постсинаптической плотности во внутреннем плексиформном слое, где RGC дендриты расположены.
Выраженное снижение переноса упомянутых белков наблюдалось после повреждения аксонов в глазах, обработанных носителем, по сравнению с наивными контролями (перечисленные здесь эффекты проиллюстрированы на рис. 4 в тексте). Инсулин, вводимый после ретракции синапсов в соответствии с режимом, показанным на рис. 1F, способствовал заметному спасению процесса переноса специфичных белков во внутреннем плексиформном слое. Количественный трехмерный анализ объема белков, занимаемого ими во внутреннем плексиформном слое, подтвердил, что инсулин способствует устойчивой синаптической регенерации по сравнению с сетчатками, обработанными чистым носителем без инсулина.
Авторы отметили, что для аксотомизированных (поврежденных) нейронов характерно наличие множественных варикозных (сосудистых) изменений вдоль дендритов, часто сопровождаемых большими ретракционными луковицами на кончиках.
 [Из литературы известно, что в мышиной модели внутриглазной гипертонии при глаукоме группы белков сетчатки в постсинаптических пространствах по-разному чувствительны к утрате синапсов; это так называемые ON, OFF-транзиентные и переходные белки, родственные нервным клеткам ганглиев сетчатки RGCs – прим. пер.].
[Из литературы известно, что в мышиной модели внутриглазной гипертонии при глаукоме группы белков сетчатки в постсинаптических пространствах по-разному чувствительны к утрате синапсов; это так называемые ON, OFF-транзиентные и переходные белки, родственные нервным клеткам ганглиев сетчатки RGCs – прим. пер.].
Оказалось, что после аксотомии повреждениями были затронуты все подтипы белков, но особенно уязвимыми оказались белки типа ON (поддерживающие) и переходные, с потерей до 65% синапсов.Инсулин способствовал поразительной регенерации возбуждающих постсинаптических объемов во всех вариантах опыта, возвращая до 93% состояния, предшествовавшего повреждению. Авторы пришли к выводу, что инсулин восстанавливает плотность постсинаптических объемов на регенерирующих RGCs-дендритах.
Инсулин восстанавливает функцию сетчатки и повышает выживаемость нейронов
 Чтобы оценить влияние инсулин-опосредованной регенерации дендритов и синапсов на функцию RGC, мы измерили два компонента электроретинографии: pSTR и PhNR. Эти сигналы – зависят от активности RGC в сетчатке грызунов и снижаются после повреждения зрительного нерва и у пациентов с глаукомой.
Чтобы оценить влияние инсулин-опосредованной регенерации дендритов и синапсов на функцию RGC, мы измерили два компонента электроретинографии: pSTR и PhNR. Эти сигналы – зависят от активности RGC в сетчатке грызунов и снижаются после повреждения зрительного нерва и у пациентов с глаукомой.
Оказалось, что pSTR и PhNR ответы были заметно снижены после повреждения зрительного нерва у мышей, получавших носитель, с уменьшением амплитуды на 48% и 60%, соответственно, по сравнению с контролем. Напротив, инсулин полностью восстанавливал амплитуды как pSTR, так и PhNR в поврежденных сетчатках через 7 дней после аксотомии, что свидетельствует о восстановлении функции RGC при световой стимуляции.

Чтобы выяснить, отражается ли про-регенеративный эффект инсулина на способность RGCs выживать после травмы, проанализировали плотность нейронов на плоских сетчатках через 1, 2, 4 и 6 недель. после аксотомии. Сетчатки из глаз, обработанные инсулином, неизменно демонстрировали более высокую плотность RGCs-меченных RGCs, чем те, которые обрабатывали носителем. Количественный анализ показал, что инсулин способствовал существенному выживанию RGC относительно глаз, обработанных PBS, через 1 неделю после повреждения зрительного нерва (инсулин: выживание 70%, носитель: выживание 46%).
Примечательно, что введение инсулина привело к устойчивой длительной нейропротекции – выживанию 60% RGCs через 2 недели после травмы. Кроме того, 25% RGCs из этих 60% выжили и через 4 и 6 недель, по сравнению с 8% в контрольных вариантах (чистый носитель).
Обсуждение (фрагменты)
Молодые дендриты чрезвычайно динамичны во время развития, быстро «разворачиваются» и «сжимаются» в ответ на внутренние и внешние раздражающие сигналы, но на стадии зрелости они становятся стабильными и структура их мало изменяется. Стабильность дендритов может быть сильно нарушена во время болезненного процесса нейродегенерации, например при глаукоме. Действительно, сокращение объема и разветвления RGC дендритных деревьев наблюдалось в модельных опытах глаукомы у приматов, кошек и грызунов, в глаукоматозных сетчатках человека.
Со своей стороны, мы показываем, что избирательное повреждение аксонов RGC вызывает быстрое сокращение дендритов и потерю сложности дерева, вплоть до явной потери нейронов. Примечательно, что введение инсулина после того, как ретракция дендритов уже произошла, способствовало быстрому отрастанию и восстановлению отростков и восстановлению общей картины дерева и его сложности.
Поскольку наше исследование было сосредоточено на классических альфа-RGC, которые характеризуются крупными полями дендритов с типичным ветвлением, ─ нет риска пропустить ретракцию или отсутствие регенерации нейронов на более компактных дендритных деревьях.
Примечательно, что спонтанная регенерация дендритов была описана у беспозвоночных. Так, сенсорные нейроны периферической нервной системы у Caenorhabditis elegans (свободноживущая нематода – крупный червь) и Drosophila (плодовая мушка) обладают устойчивой способностью восстанавливать стереотипные паттерны дендритных ветвей после лазерной абляции дендритов (разрушающего воздействия излучением).
Отрастание поврежденных дендритов под воздействием биологически активных веществ было показано в недавних работах на головном мозге мыши; в одной работе удаление одиночных дендритов привело к быстрой фрагментации конца и образованию ретракционной луковицы, в другой показано отрастание дендритов пирамидальными клетками после локального введения гепарин-связывающей молекулы, связанной с ростом.
Наши данные подтверждают, что поврежденные нейроны ЦНС наделены внутренней способностью отращивать дендриты и могут легко восстанавливать функциональные дендритные сосуды при передаче сигналов от инсулина.
Наши данные показывают, что для регенерации дендритов необходима инсулинзависимая активация как mTORC1, так и mTORC2, и эти комплексы взаимодействуют аддитивным образом, чтобы обеспечить успешное восстановление длины дендритов и сложности дерева. Оказалось, что mTORC1 и mTORC2 контролируют разные аспекты регенерации дендритов: mTORC1 необходим для ветвления и восстановления сложности кроны, тогда как mTORC2 регулировал расширение процесса и восстановление зоны дерева в целом.
Вполне вероятно, что RGC-дендриты, находящиеся в среде сетчатки с большей разрешающей способностью к росту, по отношению к зрительному нерву и в непосредственной близости от своих мишеней, требуют регенерации на более короткие расстояния, что способствует восстановлению функциональных связей. Лучшее понимание молекулярного взаимодействия между дендритом и регенерацией аксонов будет важно для разработки стратегий, которые приведут к полному восстановлению цепи.
Наши наблюдения о том, что инсулин приводит к выживанию зависимых от mTORC1 / 2 RGC после аксотомии, позволяют предположить, что увеличение связности с пресинаптическими мишенями повышает активность нейронов, что может впоследствии повысить жизнеспособность клеток. Используемый здесь преходящий режим инсулина, инициированный после ретракции дендритов и разборки синапсов, способствовал выживанию ~ 60% RGC через 2 недели после аксотомии, когда только 10% этих нейронов оставались живыми у животных, получавших носитель.
Это исследование показало, что зрелые нейроны сетчатки
наделены способностью эффективно восстанавливать дендриты и синапсы после травмы.
Мы идентифицируем применение системы инсулин – mTORC1 и mTORC2 как мощную стратегию для восстановления морфологии дендритов, улучшения функции и выживания поврежденных нейронов.
Инсулин, на практике местно применяемый в дозах до 100 ед / мл, – то есть в несколько раз выше, чем тестируемые здесь, не вызывал явных клинических признаков токсичности у людей. В связи с этим будет интересно оценить, существует ли корреляция между прогрессированием глаукомы и терапевтическим применением инсулина у пациентов, страдающих также диабетом.
В совокупности полученные данные подтверждают целесообразность использования инсулина и его аналогов в качестве регенеративных терапевтических целей, которые потенциально применимы к глаукоме и множеству других трудноизлечимых нейродегенеративных заболеваний.
Краткий Терминологический Словарь
Аксон – как и дендрит, отросток нервной клетки, но самый длинный (осевой). Служит для проведения нервного сигнала на дальнее расстояние от тела нейрона (за несколько метров).
Варикоз – расширение венозных сосудов, сопровождающееся утратой эластичности стенок сосудов
Гематоэнцефалический барьер – физиологическая преграда между капиллярной кровью и нейронами центральной нервной системы, защищающая их от прямого контакта.
Глутамат-эргический- Глутамат (глутамин) –активный участник передачи нервных сигналов; эргический – обозначает, что данное химическое вещество участвует в жизни и работе нейронов и нервных проводящих путей, то есть связанный с нейронами.
Дендрит – разветвленный отросток нервной клетки – нейрона, через который клетка получает сигналы от других нейронов (то есть, это средство коммуникации нейронов).
Деассемблирование – демонтаж, разборка (в контексте статьи)
Инсулин – специфический гормон поджелудочной железы, выполняющий множество функций в организме человека, в основном регуляторных
Комплекс m-TOR млекопитающих – TOR1 и TOR2 белки, контролирующие клеточный рост. Несмотря структурную схожесть, их функции неодинаковы, так как они работают на разных фазах жизни клетки. Рапамицин ингибирует mTORC1 и блокирует размножение клеток.
Нейрон – нервная клетка. Она электрически возбудима (то есть, это структура, которая обрабатывает, хранит и передает информацию с помощью электрических и химических сигналов).
Нейротрансмиссия – передача нервного сигнала (импульса) по цепи нейронов
Плексиформный слой – В сетчатке глаза между слоем ганглионарных клеток и слоем палочек и колбочек находятся два слоя сплетений нервных волокон со множеством синаптических контактов. Это наружный и внутренний плексиформные («сплетенные» из волокон) слои. Во внутреннем – нервный сигнал переключается с одних нейронов на другие.
Пресинаптический и постсинаптический – начальный и конечный пункты передачи сигнала нервной клетки (отростков)
Ретинальные ганглии – нейроны сетчатки глаза
Ретракция – уменьшение объема клетки или органа
Синапс – место контакта между двумя нейронами или между нейроном и получающей сигнал клеткой (то есть, это структура, отвечающая за передачу сигнала и обеспечивающая связь между отдельными клетками). Может иметь различную конфигурацию. Пример – ленточный синапс.

