Авторы
- Курышева Н.И., д.м.н., профессор, руководитель консультативнодиагностического отдела Центра офтальмологии ФМБА России. Клиническая больница № 86;
- Шаталова Е.О., кмн, врач‑офтальмолог; Сеть медицинских центров «Клиники доктора Шаталова».
В начале 60‑х годов прошлого столетия впервые возник вопрос о роли повышенного ВГД как первопричины глаукомы. В 1962 г. Strömberg c соавт. провели исследование в Шведском городе Сковдэ и установили, что в их регионе офтальмогипертензия — вполне обычное явление [1].
Это наблюдение подтверждалось впоследствии неоднократно, о чем свидетельствует недавний обзор Heijl всех опубликованных по этому поводу статей (табл.1) [2]. Первое классическое эпидемиологическое исследование с целью выяснения роли ВГД в развитии глаукомы было проведено в Уэльсе. Hollows и Graham впервые в 1966 г. применили в своем исследовании периметрию и установили, что глаукома нормального давления — весьма распространенное явление [3]. Как и в случае с офтальмогипертензией, это наблюдение впоследствии также неоднократно подтверждалось (табл. 1). Более того, в некоторых странах, например, в Японии, глаукома с повышенным ВГД — это, скорее, исключение из правил [4].
табл. 1. Число случаев развития глаукомы среди лиц с офтальмогипертензией по данным литературы [Heijl, 2011]
tabl. 1. Cases of glaucoma progression among patients with ophthalmohypertension
В связи с этим критически встал вопрос: надо ли с целью лечения глаукомы снижать повышенное ВГД? Было проведено большое количество новых эпидемиологических исследований, в которых авторы стремились выяснить, будет ли развиваться глаукомное поражение, если не снижать ВГД [5,6,7,8]. Данные, основанные на этих исследованиях, приведены в табл. 2. В целом результаты показали, что даже спустя 15 лет лишь у незначительного числа лиц с офтальмогипертензией развивается глаукома.
Следует отметить, что упомянутые выше Strömberg с соавт. наблюдали за пациентами 20 лет и обнаружили, что дефекты полей зрения возникли только у трети из них.
Ситуация стала еще более драматичной, когда в 70‑х годах 20 века в клиническую практику был введен метод компьютерной периметрии, а статическая периметрия заменила кинетическую [9,10,11]. Количество больных с дефектами полей зрения сразу удвоилось [12]. Тем не менее, эпидемиологические исследования, которые продолжались уже с применением новых технологий, убедительно свидетельствовали о том, что глаукома может развиваться даже при нормальном ВГД, а офтальмогипертензия — никогда не приводить к глаукомному поражению.
табл. 2. Удельный вес больных с глаукомой нормального давления среди общего числа больных глаукомой по данным литературы [Heijl, 2011]
tabl. 2. Density of normotensive glaucoma among total number of glaucoma patients in literature
Примечание: OH — офтальмогипертензия, dev GL — развитие глаукомы Note: OH — ophthalmohypertension, dev GL — developing of glaucoma
В связи этим критически встал вопрос: надо ли c целью лечения глаукомы снижать повышенное ВГД? Было проведено большое количество новых эпидемиологиче‑
Примечание: NTG — нормотензивная глаукома Note: NTG — normal–tension glaucoma
Таким образом, несмотря на тот факт, что многоцентровые исследования набирали оборот, сомнения в том, насколько целесообразно проводить местное гипотензивное лечение при глаукоме, оставались. Для выяснения этого вопроса были предприняты новые эпидемиологические исследования. Первое из них выполнено в Швеции, в Malmö [13,14,15,16,17], где собственно впервые и были разработаны технологии определения скорости прогрессирования глаукомы. Это было чрезвычайно важное открытие, поскольку без него невозможно получить представление об эффективности гипотензивной терапии. Действительно, добиться снижения ВГД — не то же самое, что добиться стабилизации глаукомы.
Однако в ту пору для оценки прогрессирования применяли периметрические индексы, например, MD. Основанные на регрессионном анализе, эти индексы прекрасно отражали скорость прогрессирования, но были малопригодны для определения ранних этапов прогрессирования ГОН. Для этого существенно более полезным оказался анализ светочувствительности в отдельных точках поля зрения методом GPA*. Появившаяся возможность рассчитывать скорость прогрессирования (Rate of Progression, ROP) сделала реальным не только возможность сравнивать эффективность тех или иных методов лечения глаукомы, но и оценивать значимость различных факторов риска, влияющих на развитие ГОН, включая уровень офтальмотонуса.
Уже первые эпидемиологические исследования продемонстрировали, насколько ранее удается зафиксировать признаки прогрессирования глаукомы с применением GPA по сравнению с использованием, так называемого Trend Analyses, который позволяет определить факт прогрессирования глаукомы на основании регрессионного анализа вероятности глаукомных изменений (Glaucoma Change Probability Analysis) [18,19]. Но самое главное состояло в том, что данную технологию удалось применить в первом серьезном эпидемиологическом исследовании, направленном на решение вопроса: помогает ли местное гипотензивное лечение [20].
Первые результаты
Первые результаты оказались ошеломляющими. Так, первая публикация потрясла мировое офтальмологическое сообщество: эффективность гипотензивной терапии нельзя считать доказанной [21]. Исследования продолжались, но при этом приводили к тому же выводу [22].
Несколько иными были результаты других клинических исследований, в которых оценивали лечение офтальмогипертензии. В целом они носили противоречивый характер, за исключением работы Kass et al. (1989), из которой следовало, что местное гипотензивное лечение снижает риск развития глаукомы в два раза [23]. Однако в данной работе не было выполнено достаточно качественной статистической обработки результатов. Другие работы, посвященные офтальмогипертензии, приводили к отрицательному выводу [13,17].
Это побудило к выполнению многоцентровых исследований. Так, в конце прошлого столетия и в начале нынешнего было проведено шесть многоцентровых исследований, посвященных различным аспектам глаукомы: первое — офтальмогипертензии (the Ocular Hypertension Treatment Study (OHTS) [24], второе — лечению развитой глаукомы [25], третье — глаукоме нормального давления [27,26], четвертое — впервые выявленной глаукоме (the Early Manifest Glaucoma Trial (EMGT) [20], пятое — начальной глаукоме (Collaborative Initial Glaucoma Treatment Study (CIGTS) [28]. Шестым было Европейское исследование по предотвращению глаукомы (the European Glaucoma Prevention Study (EGPS) [29]. В наши дни проводятся новые исследования, посвященные анализу результатов медикаментозного лечения глаукомы, например, UKGTS. Более подробно характеристика многоцентровых исследований приведена в табл. 3.
таблица 3. Результаты многоцентровых исследований, посвященных проблемам глаукомы
tabl. 3. The results of multi-center’s studying glaucoma’s problems
| Название исследования |
Дизайн исследования |
Группы пациентов |
Период наблюдения |
Выводы |
|
OHTS (Ocular Hypertension Treatment Study)24 |
22 центра, 1636 участников в возрасте от 40 до 80 лет. Критерии отбора — наличие офтальмогипертензии (24-30 мм рт. ст.), от-
сутствие дефектов VF, экскавации, открытый угол передней камеры. |
1) группа контроля — лица с офтальмогипертензией (ОГ), не получавшие гипотензивного лечения.
2) группа лиц с ОГ, получавших гипотензивное лечение. |
6 лет |
ВГД в группе, получавшей гипотензивное лечение, снизилось на 22,5%±9,9%, в группе контроля на 4,0% ±11,6%; Переход ОГ в ПОУГ за 60 мес. составил 4,4% и 9,5%, соответственно. |
|
AGIS (Advanced Glaucoma Interventions Study)25 |
12 центров, 591 участник, 789 глаз разделены на две группы в соответствии с последовательностью проводимого лечения:
1) аргон-лазерная трабекулопластика (АЛТ) и трабекулэктомия (ТЭК), трабекулэктомия; 2)Трабекулэктомия, АЛТ, трабекулэктомия . |
В соответствии с достижением давления цели (18 мм рт. ст.) все глаза были подразделены на 4 группы:
А — давление цели достигнуто в 100%; В — в 75%≤100%; С — в 50%≤75%; D — ≤50% случаев. |
От 6 до 13 лет |
За 6 лет наблюдения ВГД в группе А — 12,3 мм рт. ст., В — 14,7 мм рт. ст., С — 16,9 мм рт. ст., D — 20,2 мм рт. ст.
В группах B,C,D отмечалось ухудшение в VF по сравнению с группой А. Среди факторов риска снижения гипотензивного эффекта: молодой возраст и высокое исходное ВГД (для АЛТ), сахарный диабет и послеоперационное воспаление (для ТЭК) |
| CNTGS
(Collaborative Normal Tension Glaucoma Study)26 |
24 центра, 230 участников с глаукомой нормального давления. |
1 — группа контроля;
2 — группа, получавшая гипотензивное лечение (хирургическое и местное гипотензивное). |
ВГД в группе 1 и группе 2 составило 16,2±2,1 мм рт.ст. и 10,6±2,7 мм рт.ст. Прогрессирование глаукомы — в 35% и 12%, соответственно. |
|
| Название исследования |
Дизайн исследования |
Группы пациентов |
Период наблюдения |
Выводы |
|
EMGT (Early Manifest Glaucoma Trial)20 |
22 центра, 255 больных с впервые выявленной глаукомой. |
1 — группа контроля; 2 — группа, получавшая лечение: АЛТ на 360°+ бетаксолол. |
10 лет |
В среднем ВГД снизилось на 30% в группе 2, в то время как в группе 1 снижения давления не наблюдалось.
Прогрессирование глаукомы в группе 1 составило 62%, в группе 2 — 45%. |
|
CIGTS (Collaborative Initial Glaucoma Treatment Study)28 |
14 центров, 607 пациентов с впервые выявленной глаукомой. |
группа 1 — медикаментозное лечение; группа 2 — хирургическое лечение (ТЭК с применением 5-фторурацила). |
4 года |
В среднем ВГД снизилось на 48% в группе 2 и на 35% в группе 1.
Дефекты в VF были минимальными и сопоставимыми в обеих группах. В группе 2 чаще наблюдалось развитие катаракты. |
|
EGPS (European Glaucoma Prevention Study)29 |
1081 пациент с офтальмогипертензией (22-29 мм рт. ст.), отсутствием дефектов в VF и ДЗН. |
группа 1 — контрольная (плацебо); группа 2 — дорзоламид. |
5 лет |
В среднем в группе 2 ВГД снизилось на 22,1% и на 18,7% в группе 1. Статистически значимой разницы между степенью прогрессирования глаукомы при сравнении двух групп выявлено не было (13,4% и 14,1%, соответственно). |
OHTS — 1636 participants with ophthalmohypertension, no defects of VF, open angle. Control group is focused on the patients with ophthalmohypertension without any medication provided, the second group is focused on the patients with the hypotension therapy. Observation period is six years. The IOP is reduced to 22,5%±9,9% in the group with the hypotensive regime, when it is reduced only to 4,0% ±11,6% in the control group; POUG progression was 9,5% and 54% respectively during the 60 months.
AGIS — 591 participants. 789 eyes were divided into two groups in correspondence with the treatment sequence: 1) ALT, trabeculotomy, trabeculotomy 2) Trabeculotomy, ALT, trabeculotomy
All the eyes were divided into four groups in correspondence with the pressure reaching its aim (18 mm Hg): A — the pressure aim is reached in a 100 %;
B — 75%≤100%; С — в 50%≤75%; D — ≤50% сases. The statistics of IOP for the 6 years of observation is the following: Group A — 12,3 mm Hg, B — 14,7, C — 16,9,
D — 20,2. In comparison with the group A, there was detected deterioration in VF in groups B, C and D.
CNTGS — 230 participants with the normal-tension glaucoma. 1st group is the control group, 2nd group has a treatment. In both groups the IOP 16,2± 2,1 and 10,6 ±2, and the progression was 35% and 12 % correspondingly.
Следует подчеркнуть, что во многих упомянутых исследованиях существовали группы контроля, в которых гипотензивное лечение не проводили, а больных просто наблюдали. Как было отмечено выше, основной целью всех исследований было проследить роль ВГД в прогрессировании ГОН (Табл. 4).
таблица 4. Результаты многоцентровых исследований по изучению роли ВГД в развитии и прогрессировании глаукомы [Heijl, 2011]
tabl. 4. The results of multi-center’s studying the role of IOP in glaucoma’s progression
|
Исследование |
Снижение/Повышение риска прогрессирования ГОН |
Cтепень риска (доверительный интервал) |
|
EMGT |
Снижается на 10-13% на каждый мм рт. ст. снижения ВГД |
0,90 (0,86-0,94) |
|
OHTS |
Повышается на 10% на каждый мм рт. ст. повышения ВГД |
1,11 (1,04-1,17) |
|
EGPS |
Повышается на 12% на каждый мм рт. ст. повышения ВГД |
1,12 (1,03-1,23) |
| Canadian Glaucoma Study
(Канадское исследование по глаукоме) |
Повышается на 19% с каждым мм рт. ст. повышения ВГД |
1,19 (1,05-1,36) |
EMGT — IOP decrease with every mm Hg can reduce glaucoma progression to 10-13%
EMGT — 255 participants with barely detectable and untreated glaucoma. The exception is the terminal stages of glaucoma with the IOP ≥30 mm Hg. 1st group is the control group, 2nd group has a treatment: trabeculoplasty and betaxololi. The IOP in groups 1 and 2 was 20,6± 4,1 and 20,9 ±4,1 correspondingly. On the average, the IOP decreased to 30% in group 2, when there was no decrease detected in a group 1. The visible glaucoma progression was 62% in group 1 and 45% in group 2.
CIGTS — 607 patients with the newly detectable glaucoma. 1st group is the control group, 2nd group has a treatment: 1-hypotension therapy, 2-trabeculotomy with 5-phthoruracili. The IOP in groups 1 and 2 was 27 and 28 mm Hg correspondingly. On the average, the IOP decreased to 48% in group 2, and to 35% in group 1. In both groups the defects in VF were minimal.
EGPS — 1081 patients with ophthalmohypertension, no defects of VF and optic nerve. 1st group is the control group, 2nd group has a treatment with dorzolamide. On the average, the IOP decreased to 22,1% in group 2, and to 18,7% in group 1. In comparison of the two groups, there was detected no statistically significant difference in terms of the glaucoma progression level.
OHTS — the IOP rise with every mm Hg can be the cause of glaucoma progression up to 10%
EGPS — the IOP rise with every mm Hg can be the cause of glaucoma progression up to 12%
CGS — the IOP rise with every mm Hg can be the cause of glaucoma progression up to 19%
В таблице показано, насколько снижается/повышается риск прогрессирования ГОН при снижении/повышении ВГД.
По мере того, как проходили годы, результаты этих исследований пересматривали и подвергали новой статистической обработке. Например, если первые результаты CNTGS были негативными [26], то когда анализ был выполнен повторно с учетом прогрессирования катаракты, выяснилось, что глаукома прогрессировала чаще у лиц, не получавших лечение [27]. По данным EMGT также оказалось, что снижение ВГД на 25% уменьшает риск прогрессирования заболевания вдвое [20]. На этом фоне наиболее слабые доказательства эффективности гипотензивной терапии были получены в AGIS (2000).
Результаты EGPS не выявили положительного эффекта от местного лечения глаукомы (применяли дорзоламид). Возможно, это было связано с очень низким гипотензивным действием препарата (в целом в группе, получавшей лечение, ВГД было снижено в среднем лишь на 1 мм рт. ст.), кроме того, многие пациенты “выходили” из данного исследования [29].
Наблюдение за больными в EMGTS на протяжении многих лет (более 8) показало, что глаукома прогрессирует у 59% больных, причем, как правило, при нормальном ВГД.
В результате проведенных исследований было обнаружено много полезной информации, касающейся, прежде всего, влияния ВГД на прогрессирование ГОН (табл. 4). Когда были проанализированы эти факторы, то оказалось, что роль снижения офтальмотонуса более значительна, чем это представлялось ранее, поскольку было установлено, что снижение ВГД на 1 мм рт. ст. снижало риск развития глаукомы на 10–19% [30,31,32,33,34,35]. Таким образом, в результате упомянутых исследований появилась еще одна важная рекомендация: давление цели должно быть ниже, чем это было принято считать ранее, и его необходимо переоценивать на протяжении наблюдения за больным, базируясь на результатах определения скорости прогрессирования глаукомы в каждом конкретном случае.
Кроме того, оказалось, что скорость прогрессирования глаукомы весьма вариабельна. Она зависит не только от факторов риска или формы глаукомы (рис.1), но еще от разных, не установленных пока обстоятельств [36]. Все это привело к одной очень важной рекомендации по наблюдению за больными глаукомой: существует необходимость более частого выполнения периметрии (не реже трех раз в год в первые два года наблюдения) [37].
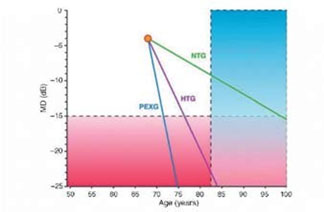
рис.1. Скорость прогрессирования глаукомы в зависимости от ее формы: наибольшая — при псевдоэксфолиативной глаукоме, наименьшая — при глаукоме нормального давления (цит. по Heijl A., 2009).
Fig. 1. The rate of glaucoma progression according to the form of disease: highest in cases with pseudoexfoliative glaucoma, lowest — in normal-tension glaucoma (Heijl A., 2009).
Проведенные исследования изменили саму парадигму мониторинга больных глаукомой. Стало очевидным, насколько важно определять прогрессирование ГОН. Однако вопрос “есть прогрессирование или нет?” со временем изменился на “какова скорость прогрессирования?”
Какова скорость прогрессирования ГОН по результатам многоцентровых исследований?
Важно подчеркнуть, что только в двух из них изучали скорость прогрессирования ГОН у пациентов, не получавших лечение. Это — Collaborative NormalTension Glaucoma Study (CNTGS 1998) и Early Manifest Glaucoma Trial (EMGT) [20,26]. Можно сказать, что это — “естественное” течение ГОН, и информация о том, как быстро она прогрессирует и от чего это зависит, представляется особенно ценной. Согласно данным CNTGS и EMGT, скорость ухудшения MD у больных глаукомой, не получавших лечения, составляет 0,4dB/год [20,26]. В последующем большее внимание было уделено изучению скорости прогрессирования ГОН в клинической практике, т.е. на фоне лечения [32,33,37]. Можно сказать, что это — ключевой момент в мониторинге глаукомы, поскольку именно в этом случае удается определить риск слепоты у конкретного больного, что отражено в Европейских рекомендациях (European Glaucoma Society). Кроме того, появляется возможность изучить, с какими именно факторами риска связана скорость прогрессирования глаукомы.
В этом плане особого внимания заслуживают исследования, выполненные в Университетской клинике Skåne в Malmö (Швеция), где наблюдается основная масса больных глаукомой южной части страны с населением 300 тыс. человек. Таким образом, исследование проведено не на отобранном контингенте, а на обычных больных глаукомой с разной тяжестью заболевания. Именно в глаукомном отделении этой клиники в 1996 г. была разработана программа периметрии SITA*. В исследовании участвовали все больные глаукомой, обращавшиеся в эту клинику с марта 1996 по 2005 г.г. Их число составило 583, причем 38% приходилось на псевдоэксфолиативную глаукому (ПЭГ). Среднее количество периметрических тестирований (SITA) — 8,9, среднее значение MD — 10,0 dB. При этом анализировали исходное состояние поля зрения и вид лечения. Среднее количество антиглаукомных капель составило 3. Максимальное их назначение за период наблюдения — 30. В 179 случаях была выполнена аргон‑лазерная трабекулопластика (АЛТ), причем в 127 случаях однократно, в 48 — дважды и в 4 — трижды и более, в 60 глазах — синустрабекулэктомия (СТЭК).
Скорость прогрессирования ГОН, полученная в данном исследовании, представлена на рис.2, из которого видно, что у основной части больных глаукомой она составила ‑0,80 dB⁄год.
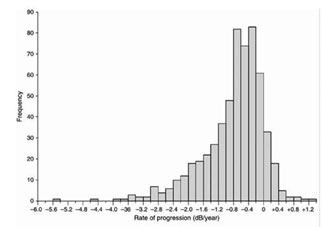
рис.2. Скорость прогрессирования ГОН по данным Шведского исследования [30].
Fig. 2. The rate of normal-tension glaucoma progression according to a Swedish study [30].
Каковы факторы риска прогрессирования ГОН, выявленные в ходе многоцентровых исследований?
Этот вопрос является одним из ключевых, поскольку позволяет, во‑первых, выделить группу/группы пациентов, нуждающихся в более частом и детальном мониторинге, во‑вторых, пересмотреть стратегии лечения, которые, очевидно, должны быть более жесткими у пациентов, имеющих высокий риск прогрессирования ГОН. Мультивариационный анализ показал, что среди факторов риска прогрессирования имеют место возраст, среднее ВГД, исходное значение MD и вид терапии (чаще ГОН прогрессировала у больных, получавших более агрессивное лечение: АЛТ и СТЭК, что отражено в табл. 5).
табл. 5. Факторы риска прогрессирования ГОН по данным Шведского исследования
tabl. 5. Risk factors for normal-tension glaucoma progression according to Swedish study
| Variable |
Reference |
Slope |
Significance |
| Age |
N/A |
–0.021 |
0.000 |
| Mean IOP |
N/A |
–0.028 |
0.011 |
| MD* |
Worse than — 10.03 dB |
–0.188 |
0.004 |
| ALT† |
No |
–0.081 |
0.021 |
| Trabeculectomies† |
No |
–0.283 |
0.012 |
Примечание: Age — возраст, Mean IOP — среднее значение ВГД, MD — среднее отклонение, ALT — аргон-лазерная трабекулопластика, Trabeculectomies — предшествующие трабекулэктомии. N/A — фактор не может быть учтен
По данным A.Heijl [42] скорость прогрессирования ГОН весьма вариабельна, и в среднем от нормы до полной слепоты проходит 50 лет. Однако достаточно быстрое прогрессирование (больше 1,0 dB/год) наблюдалось не так редко. Это важный аспект, поскольку, как было показано Mills et al. в 2006 г. [43], при такой скорости через 10‑15 лет глаукома переходит из начальной стадии в развитую, а из развитой в далеко зашедшую.
Влияет ли уровень ВГД на скорость прогрессирования ГОН?
Роль повышенного офтальмотонуса в прогрессировании ГОН подчеркивалась неоднократно [33,35,44]. Главный вывод этих исследований: снижение ВГД на 1 мм рт.ст. снижает риск прогрессирования ГОН на 10%. Можно предположить, что этим фактором объясняется различная скорость прогрессирования ГОН в разных исследованиях. Действительно, если группы больных в них отличаются по возрасту, степени снижения ВГД за период наблюдения, а также формой глаукомы (например, в некоторых исследованиях анализируются, в том числе, данные больных с узким профилем УПК), то результаты этих исследований нельзя сравнивать между собой.
Согласно данным Шведского исследования, уровень ВГД является фактором риска прогрессирования ГОН, причем на первых этапах анализа (без учета проводимой терапии) имели значение также размахи ВГД. При сравнении полученных данных с результатами аналогичных исследований в других странах авторы подчеркивают, что среднее значение ВГД на протяжении наблюдения во всех исследованиях приблизительно одинаково и составляет 20,0 мм рт. ст. по Гольдману [45,46].
Тем не менее, следует признать, что результаты исследования роли ВГД в развитии ГОН носят противоречивый характер. В 2012 г. Ernest P [47] с соавторами проанализировали 412 публикаций, посвященных определению скорости прогрессирования ГОН методом периметрии. Авторы отобрали 12 работ, имевших наиболее достоверные результаты. В 65% анализируемых статей была отмечена связь между прогрессированием ГОН и повышенным ВГД. Однако эта связь не всегда была прямой, из чего следует, что прогрессирование ГОН в ряде случаев может проходить на фоне нормального ВГД.
Столь же спорным остается вопрос о влиянии флуктуаций ВГД на прогрессирование ГОН. По мнению Heijl, это связано с тем, что в изучении данного вопроса надо учитывать, получают ли больные какую‑либо антиглаукомную терапию. Это объясняет большой разброс данных в литературе [40,41,48,49,50]. Если больные получают гипотензивную терапию, то роль играет именно уровень ВГД, а не его флуктуации. По данным AGIS, флуктуации ВГД при нормотензивной глаукоме не оказывают влияние на прогрессирование ГОН и имеют значение только при низком уровне офтальмотонуса (AGIS, 2000).
Согласно данным EMGT, cкорость прогрессирования глаукомы с высоким ВГД составила 1,3 dB/год, а при ПЭГ — 3,1 dB/год (EMGT) [20].
Возраст и прогрессирование ГОН
Наиболее важным фактором риска прогрессирования ГОН авторы Шведского исследования называют возраст, причем этот вывод совпадает с мнением других авторов [38,39,32,51]: с каждым годом жизни риск прогрессирования возрастает на 1,04 условную единицу риска. Роль возраста в прогрессировании ГОН подчеркивается в исследовании AGIS в 2000 г., а также в Канадском глаукомном исследовании [32].
Следует отметить, что в литературе встречаются единичные публикации, указывающие на возможность низкой скорости прогрессирования ГОН: ‑0,35 dB/год, что было продемонстрировано канадскими авторами [38, 39]. По их данным, ГОН прогрессировала у 45 больных, в то время как у 153 — прогрессирование не отмечено. Здесь уместно обратить внимание на тот факт, что в Канадском исследовании пациенты имели более молодой возраст, ВГД у них было ниже, ПЭС встречался реже, а главное, это было проспективное исследование, в котором больных наблюдали и лечили более тщательно, а также пациенты лучше выполняли назначения врача.
Влияние стадии глаукомы на прогрессирование ГОН
Спорным остается вопрос о влиянии исходного MD на скорость прогрессирования ГОН. Так, в описываемом Шведском исследовании авторы не заметили влияния исходной тяжести заболевания на его прогрессирование. Напротив, сравнивая парные глаза, они выявили более высокую скорость прогрессирования в лучшем глазу, в котором степень глаукомного поражения была менее выражена. В то же время многие авторы отмечают обратное явление [34,52, 53]. Недавнее исследование Forchheimer et al. [51] выявило отсутствие связи прогрессирования ГОН с исходной стадией заболевания. Подобные противоречия могут объясняться различной исходной степенью тяжести заболевания. Действительно, скорость прогрессирования ГОН при далекозашедшей стадии по данным периметрии может оказаться ниже, чем, например, при развитой стадии.
Особого внимания заслуживает исследование скорости прогрессирования ГОН без лечения. При наблюдении в течение 6 лет за 46 пациентами с ПОУГ высокого давления, 57 — больными ГНД и 15 — с ПЭГ и выполнении периметрии каждые три месяца, Heijl и соавт. отметили, что средняя скорость прогрессирования ГОН в первой группе (глаукома повышенного давления) составила ‑1,08 dB/ год, при ГНД ‑0,36 dB/год, а при ПЭГ ‑3,13 dB/год. В среднем, за 6 лет прогрессирование имело место у 68% больных, причем при ПОУГ высокого давления в 74% случаев, при ГНД — в 56%, а при ПЭГ — в 93%. Примечательно, что период времени, при котором возможен распад зрительных функций, существенно различается при рассматриваемых формах глаукомы. При ПЭГ этот период составляет всего 19,5 месяцев, в то время как при ПОУГ высокого давления — 44,8 месяцев, а при ГНД — 61,1 месяц.
Сравнивая скорость прогрессирования среди больных глаукомой, не получавших лечения, Heijl et al. отмечают, что она существенно выше среди пожилых (1,48 dB/год), чем среди молодых пациентов (0,6dB/год). В данном исследовании средняя скорость изменения индекса MD, выбранная в качестве критерия прогрессирования, составила ‑1,8 dB/год [42].
Особого внимания заслуживает работа A. Martinez et al. [54], в которой авторы, помимо традиционно оцениваемых в подобных исследованиях ВГД, стадии заболевания и вида лечения, обратили внимание на показатели ретробульбарного кровотока и АД, в том числе, в связи с приемом антигипертензивных препаратов. Наблюдая за пациентами в течение 5 лет, авторы обнаружили, что прогрессирование глаукомы связано не с ВГД или его флуктуациями, а с уровнем перфузионного давления, диастолического АД, скоростью кровотока в глазной артерии, а также с индексом сопротивления (RI) в глазной артерии и задних коротких цилиарных артериях. Кроме того, существенное влияние на прогрессирование ГОН оказывает прием системных препаратов для снижения АД.
При сравнении клинических показателей у больных глаукомой в препериметрическую и периметрическую стадию заболевания наши недавние исследования определили важную прогностическую значимость показателей кровотока в тех же сосудах, что отмечены в работе Martinez [55].
Факторы риска прогрессирования ГОН, выявленные в ходе многоцентровых исследований, резюмированы в табл. 6.
табл. 6. Факторы риска, влияющие на прогрессирование ГОН (по данным многоцентровых исследований, посвященных глаукоме)
tabl. 6. Risk factors for normal-tension glaucoma progression according to Swedish study
|
Study |
EMGT |
CNTGS |
AGIC |
OHTS |
EGPS |
| IOP |
√ |
− |
√ |
√ |
√ |
| Damage |
√ |
− |
√ |
NA |
NA |
| Age |
√ |
− |
√ |
√ |
√ |
| Exfoliations |
√ |
× |
× |
× |
√ |
| Disk haemorrhages |
√ |
√ |
× |
√ |
× |
Примечание: IOP — внутриглазное давление, Damage — исходное глаукомное поражение, Age — возраст, Exfoliations — наличие ПЭС, Disc haemorrhages — выявление геморрагий по краю ДЗН; √ — имеет влияние, “ — “ — не имеет влияния, × — фактор не учитывался (не анализировался), NA — фактор не может быть учтен. Цит. по L Rossetti, F Goni, 2010 [56].
Какое влияние оказывает гипотензивное лечение на прогрессирование ГОН?
Ответ на этот вопрос всегда был основным в проведении любого многоцентрового исследования по глаукоме. В каждом из них сравнивали различные стратегии лечения, но только в двух — в качестве контроля использовали группы больных, не получавших лечения (см. выше). Однако особого внимания заслуживает недавнее исследование, проведенное в Великобритании (United Kindom Glaucoma Treatment Study, UKGTS) [57]. Это первое в мире рандомизированное плацебо‑контролируемое исследование для выявления эффективности местной гипотензивной терапии (латанопрост), выполненное в 10 центрах. В исследовании участвовали 516 пациентов с глаукомой. В течение 2 лет всем обследуемым периметрию выполняли 11 раз.
В определенной степени дизайн UKGTS напоминал дизайн EMGT: исходное ВГД в UKGTS было 19,9 мм рт. ст., а в EMGT — 20,6 мм рт. ст.; возраст обследуемых пациентов также одинаков (66 лет в UKGTS и 68 лет в EMGT). Если сравнить результаты наблюдения в этих двух исследованиях за один и тот же период наблюдения (24 месяца), то прогрессирование оказалось несколько более высоким в UKGTS: у 15,2% больных, получавших лечение, в то время как в EMGT — у 11% больных.
Применение методов визуализации ДЗН и слоя нервных волокон сетчатки, наряду с периметрией, повышает информативность оценки прогрессирования ГОН и делает информацию более достоверной, сокращая к тому же период проведения исследования. Именно это было сделано в UKGTS. Однако данные результаты еще не опубликованы.
В UKGTS был сделан еще один очень важный вывод. Поскольку у 2/3 больных, не получавших лечения, прогрессирования глаукомы за 2 года не было обнаружено, то возникает вопрос, стоит ли лечить всех больных с установленным диагнозом глаукомы? Эта проблема представляется очень важной и чрезвычайно деликатной. Предложение ограничиться наблюдением за пациентами с впервые установленным диагнозом с целью определения у них скорости прогрессирования (прежде, чем начинать лечение) высказывалась ранее [32,38,46]. В то же время неоднократно поднимается вопрос о том, как непросто определить скорость прогрессирования, к тому же она может изменяться в процессе течения глаукомы [33,58].
Заключение
Таким образом, из обзора литературных данных следует, что представления о роли ВГД, как диагностическом критерии глаукомы, а также как о факторе, влияющем на ее прогрессирование, претерпевали существенные изменения по мере того, как методы диагностики глаукомы совершенствовались, а клинические исследования становились все более масштабными, причем с неизменным улучшением их дизайна.
Выводы наиболее значимых исследований сводятся к необходимости снижения ВГД в лечении глаукомы. Однако уже сегодня встает вопрос о дифференцированном подходе к выбору пациентов, которые действительно нуждаются в этом лечении.
Литература
- Strömberg Ocular hypertension. Frequency, course and relation to other disorders occurring in glaucoma, as seen from mass survey of all inhabitants over forty years of age in a Swedish town. Acta Ophthlmol Suppl. 1962; Suppl 69:1‑75.
- Heijl Perimetry, tonometry and epidemiology: the fate of glaucoma management. Acta Ophthalmol. 2011:309–315
- Hollows , Graham P. Intra‑ocular pressure, glaucoma, and glaucoma suspects in a defined population. Br J Ophthalmol.1966;50(10):570‑86.
- Iwase A, Suzuki Y, Araie M et (2004): The prevalence of primary open‑angle glaucoma in Japanese: the Tajimi Study. Ophthalmology 111:1641–1648.
- Keltner L., Johnson C.A., Cello K.E., et al. Visual field quality control in the Ocular Hypertension Treatment Study (OHTS). J Glaucoma. 2007;16(8):665–669.
- Leske MC, Heijl A, Hyman L, Bengtsson B. Early Manifest Glaucoma Trial: design and baseline data. 1999 Nov;106(11):2144–53.
- Octopus automated projection perimetry. Evidence for a learning effect. Acta Ophthalmol (Copenh) 65(3):326–333.
- Simon S., Fung S., Lemer C., Russell R., Malik R., Crabb Are practical recommendations practiced? A national multi‑centre cross‑sectional study on frequency of visual field testing in glaucoma. Br J Ophthalmol. 2013;97:843–847.
- Heijl A., Lundqvist L. (1984) The frequency distribution of earliest glaucomatous visual field defects documented by automatic perimetry. Acta Ophthalmology. 1984;62(4):658‑664.
- Singh , Shrivastava A. Intraocular pressure fluctuations: how much do they matter? Curr Opin Ophthalmol. 2009;20:84–87.
- Sommer , Tielsch J.M., Katz .J, et al. Racial differences in the cause‑specific prevalence of blindness in east Baltimore. N Engl J Med. 1991;325(20):1412–7.
- Heijl A. Automatic perimetry in glaucoma visual field screening. A clinical Albrecht Von Graefes Arch Klin Exp Ophthalmol. 1976 Jul 26;2000(1):21–37.
- Epstein DL, Krug JH Jr, Hertzmark E, Remis LL, Edelstein A long‑term clinical trial of timolol therapy versus no treatment in the management of glaucoma suspects. Ophthalmology. 1989 Oct;96(10):1460–1467.
- Gordon MO, Kass The Ocular Hypertension Treatment Study: design and baseline description of the participants. Arch Ophthalmol. 1999 May;117(5):573– 83.
- Heijl A, Krakau An automatic perimeter for glaucoma visual field screening and control. Construction and clinical cases. Albrecht Von Graefes Arch Klin Exp Ophthalmol. 1975 Oct 17;197(1):13–23.
- Johnson A., Adams A.J., Casson E.J., Brandt J.D. Blue‑on‑yellow perimetry can predict the development of glaucoma‑tous visual field loss. Arch Ophthalmology 1993;111:645–50.
- Russell R.A., Crabb P., Malik R., et al. The relationship between variability and sensitivity in large‑scale longitudinal visual field data. Invest Ophthalmology Vis Sci. 2012;53(10):5985–5990.
- Jansonius M. On the accuracy of measuring rates of visual field change in glaucoma. Br J Ophthalmol. 2010;94(10):1404‑1405.
- Susanna R. Vessani ARVO E‑Abstract 5287. Invest Ophthalmol Vis Sci 2009;1:50.
- Heijl A, Leske MC, Bengtsson B, et Reduction of intraocular pressure and glaucoma progression: results from the Early Manifest Trial. Arch Ophthalmol 2002;120:1268–79.
- Drance , Anderson D.R., Schulzer M. Risk factors for progression of visual field abnormalities in normal‑tension glaucoma. Am J Ophthalmol. 2001;131(6):699– 708.
- Rao L., Yadav R.K., Begum V.U., et al. Role of visual field reliability indices in ruling out glaucoma. JAMA Ophthalmol. 2015;133(1):40‑44.
- Johnson A., Adams A.J., Casson E.J., Brandt J.D. Blue‑on‑yellow perimetry can predict the development of glaucoma‑tous visual field loss. Arch Ophthalmology 1993;111:645–50.
- Goni J. and the Glaucoma Progression Spanish Study Group. Estudio multicentrico Espanol Progress II sobre ritmos de progresion del campo visual en el glaucoma: resultados preliminares de la fase retrospectiva. Oral presentation at the 7th Spanish Glaucoma Society meeting, Alicante.Spain. 2012.
- Advanced Glaucoma Intervention 2. Visual field test scoring and reliability. Ophthalmology. 1994 Aug;101(8):1445–55.
- Collaborative Normal‑Tension Glaucoma Study Group . The effectiveness of intraocular pressure reduction in the treatment of normal‑tension Am J Ophthalmol. 1998;126(4):498–505.
- Collaborative Normal‑Tension Glaucoma Study Comparison of glaucomatous progression between untreated patients with normal‑tension glaucoma and patients with therapeutically reduced intraocular pressures. Am J Ophthalmol. 1998;126(4):487–97.
- Mikelberg S., Drance S.M. The mode of progression of visual field defects in glaucoma. Am J Opththalmol. 1984;98(4):443‑445.
- Miglior , Pfeiffer N., Torri V., Zeyen T., Cunha‑Vaz J., Adamsons I. Predictive factors for open‑angle glaucoma among patients with ocular hypertension in the European Glaucoma Prevention Study. Ophthalmology. 2007;114:3–9.
- Heijl , Buchholz P., Norrgren G., et al. Rates of visual field progression in clinical glaucoma care. Acta Ophthalmology. 2013;91(5):406–12.
- Medeiros A., Alencar L.M., Zangwill L.M., Bowd C., Sample P.A., Weinreb R.N. Prediction of functional loss in glaucoma from progressive optic disc damage. Arch Ophthalmol. 2009;127:1250–1256.
- Chauhan B.C., Mikelberg S., Balaszi A.G., LeBlanc R.P., Lesk M.R., Trope G.E. Canadian Glaucoma Study: 2. risk factors for the progression of open‑angle glaucoma. Arch Ophthalmol. 2008;126:1030–1036.
- Gordon M.O., Beiser J.A., Brandt D. et al. The Ocular Hypertension Treatment Study: baseline factors that predict the onset of primary open‑angle glaucoma. Arch Ophthalmology 2002; 120:714–720; discussion 829–730.
- Kovalska M, Grieshaber MC, Schötzau A, Katamay R, Hauenstein D, Flammer J, Orgül S. Detection of visual field progression in glaucoma. Klin Monbl 2008 May;225(5):342–5.
- Medeiros A., Weinreb R.N. Visual field progression. Ophthalmology. 2010;117:851– 852.
- Heijl A, Bengtsson B, Hyman L, Leske Natural history of open‑angle glaucoma. Ophthalmology 2009;116:2271–2276.
- Chauhan C., Garway‑Heath D.F., Goni F.J., et al. Practical recommendations for measuring rates of visual field change in glaucoma. Br J Opthalmol. 2008;92(4):569– 573.
- Drance , Anderson D.R., Schulzer M. Risk factors for progression of visual field abnormalities in normal‑tension glaucoma. Am J Ophthalmol. 2001;131(6):699– 708.
- Forchheimer I, de Moraes C.G., Teng C., Folgar F., Tello C., Ritch R., Liebmann J.M. Baseline mean deviation and rates of visual field change in treated glaucoma patients. Eye. 2011;25:626–632.
- Bengtsson , Leske M.C., Hyman L. Heijl A. Fluctuation of intraocular pressure and glaucoma progression in the early manifest glaucoma trial. Ophthalmology. 2007;114:205–209.
- Musch DC, Lichter PR, Guire KE, Standardi CL. The Collaborative Initial Glaucoma Treatment Study: study design, methods, and baseline characteristics of enrolled Ophthalmology. 1999 Apr;106(4):653‑62.
- Heijl , Bengtson B., Hyman L., et al. Natural history of open angle glaucoma. Ophthalmology. 2009;116(12):2271–2276.
- Miglior S, Zeyen T, Pfeiffer N, Cunha‑Vaz J, Torri V, Adamsons I; European Glaucoma Prevention Study (EGPS) Results of the European Glaucoma Prevention Study. Ophthalmology. 2005 Mar;112(3):366‑75.
- Medeiros A., Weinreb R.N. Visual field progression. Ophthalmology. 2010;117:851– 852.
- Keltner L., Johnson C.A., Quigg J.M., et al. Invest Ophthalmol Vis Sci. 2004;45: E‑Abstract 2134. Presented at 76th ARVO meeting.
- Ng , Sample P.A., Pascual J.P., et al. Comparison of visual field severity classification systems. J Glaucoma. 2012;21(9):586–589.
- Ernest , Viechtbauer W., Schouten J. et al. The influence of the assessment method on the incidence of visual field progression in glaucoma: a network metaanalysis. Acta Ophthalmol. 2012;90:10–19.
- Sekhar G.C., Naduvilath J., Lakkai M., et al. Sensitivity of Swedish Interactive Threshold Algorithm in Humphrey visual field testing. Ophthalmology. 2000;107(7):1303‑1308.
- Musch DC, Lichter PR, Guire KE, Standardi The Collaborative Initial Glaucoma Treatment Study: study design, methods, and baseline characteristics of enrolled patients. Ophthalmology. 1999 Apr;106(4):653–62.
- Sekhar G.C., Naduvilath J., Lakkai M., et al. Sensitivity of Swedish Interactive Threshold Algorithm in Humphrey visual field testing. Ophthalmology. 2000;107(7):1303–1308.
- Forchheimer I, de Moraes C.G., Teng C., Folgar F., Tello C., Ritch R., Liebmann J.M. Baseline mean deviation and rates of visual field change in treated glaucoma patients. Eye. 2011;25:626–632.
- Strömberg Ocular hypertension. Frequency, course and relation to other disorders occuring in glaucoma, as seen from mass survey of all inhabitants over forty years of age in a Swedish town. Acta Ophthalmol Suppl. 1962;69:1–75.
- Brusini, Johnson C.A. Staging functional damage in glaucoma: review of different classification methods. Surv Ophthalmol. 2007;52(2):156–179.
- Martinez A., Sanchez‑Salorio M. Predictors for visual field progression and the effects of treatment with dorzolamide 2% or brinzolamide 1% each added to timolol 0.5% in primary open‑angle glaucoma. Acta 2010;88:541–552.
- Kurysheva I., Irtegova E.Y., Parshunina O.A., Kiseleva T.H., Ardzevnishvili T.D.[New technology in diagnosis of primary open‑angle glaucoma]. Novye tekhnologii v diagnostike pervichnoĭ otkrytougol’noĭ glaukomy. [National Journal glaucoma]. Nacional’nyĭ zhurnal glaucoma. 2015;14:22−31. (in Russ.).
- Rossetti , Goni F., Denis P., Bengtsson B., A Martinez and Heijl A. Focusing on glaucoma progression and the clinical importance of progression rate measurement: a review Eye. 2010;24:1– 7.
- Garway‑Heath , Crabb D., Bunce C., Lascaratos G. et al. Latanoprost for openangle glaucoma (UKGTS): a randomised, multicentre, placebo‑controlled trial. Published Online December 19, 2014:(14)62111–5.
- Siderov , Tiu Al. Variability of measurements of visual acuity in a large eye clinic.Acta Ophthalmology Scand. 1999;77:673–676

