Авторы
- Алексеев И.Б., профессор, д.м.н., профессор кафедры офтальмологии, руководитель отдела глаукомы;
- Иомдина Е.Н., д.б.н., профессор; главный научный сотрудник отдела патологии рефракции;
- Аливердиева М.А., аспирант кафедры офтальмологии;врач офтальмологического отделения;
- Стулова А.Н., студент факультета фундаментальной медицины;
- Непесова О.М., заведующая офтальмологическим отделением.
Первичная открытоугольная глаукома (ПОУГ) занимает лидирующую позицию среди причин необратимой потери зрения и инвалидности в большинстве стран мира, том числе и в России [1]. Ситуация усугубляется тенденцией к увеличению заболеваемости, трудностями в ранней диагностике и лечении глаукомы, в связи с чем в настоящее время все большее значение приобретают механизмы совершенствования системы информативного скрининга и мониторинга этого заболевания.
Согласно результатам эпидемиологических исследований [2], одним из таких механизмов является переход от модели массового скрининга с применением единственного метода диагностики — тонометрии, характеризующегося высоким процентом как ложноположительных, так и ложноотрицательных результатов, к модели целевого скрининга — концепции, при которой скрининг проводится только среди лиц с высоким риском развития заболевания, но с применением расширенного комплекса диагностических методов.
Основой для целевого скрининга являются установленные факторы риска развития заболевания, и чем точнее будут определены факторы риска, тем выше эффективность целевого скрининга как с медицинской стороны, так и с экономической, учитывая, что при обследовании целевой группы будет задействовано несколько методов диагностики.
Для ПОУГ среди факторов риска развития чаще всего выделяют следующие: наследственность, пожилой возраст, артериальную гипертензию, сахарный диабет, органические (атеросклероз) и функциональные (периферические сосудистые спазмы, мигрень, болезнь Рейно, ночная гипотония, «немая» ишемия) нарушения кровообращения, заболевания щитовидной железы и т. д. [1].
Часть из представленных факторов общеприняты (возраст, наследственность и т. д.), другие являются предметом дискуссий. В том числе обсуждается взаимосвязь заболеваний щитовидной железы и глаукомы: с одной стороны, в последнее время появляются все новые данные о связи глаукомы с эндокринной патологией [3-8], а с другой, в ряде других исследований данная связь опровергается [9-11].
Цель настоящей работы — изучение связи между изменениями гормонального профиля щитовидной железы и развитием глаукомы на основании ретроспективного анализа данных амбулаторных карт пациентов многопрофильного клинического центра.
Материалы и методы
В ходе исследования были проанализированы данные амбулаторных карт пациентов, обратившихся в офтальмологическое отделение Филиала ФБУЗ «Лечебно-реабилитационный центр Минэкономразвития России» в 2016 г. Были выделены 2 группы: пациенты с установленным ранее диагнозом ПОУГ (n=71), включая 57 женщин и 14 мужчин, и контрольная группа (n=76), в которую вошли 52 женщины и 24 мужчины. Средний возраст пациентов в группе ПОУГ составил 67,12±6,47 года, в контрольной группе — 65,30±5,97 года (p>0,5).
В контрольную группу включили пациентов с одним или несколькими из следующих офтальмологических диагнозов: возрастная катаракта, пресбиопия, синдром «сухого глаза», задняя отслойка стекловидного тела, астенопия. Для оценки функционального состояния щитовидной железы были использованы заключение эндокринолога, а также лабораторные показатели: уровни тиреотропного гормона (ТТГ), свободного тироксина (Т4), антител к пероксидазе. Дополнительно исследовали биохимические показатели крови: уровень глюкозы, холестерина (ХС), липопротеидов высокой и низкой плотности (ЛПВП, ЛПНП), триглицеридов (ТГЦ).
Статистическая обработка данных выполнена с помощью пакета прикладных программ «Statistica for Windows» v. 8.0, StatSoftInc. (США). Статистически значимыми считались различия при р<0,05 (95% уровень значимости).

Рис. 1. Средний уровень свободного Т4 (пмоль/л) по данным лабораторных исследований у пациентов с ПОУГ и в контрольной группе (* — критерий Манна – Уитни, p=0,05)
Результаты
При анализе лабораторных показателей установлено, что средний уровень свободного Т4 у пациентов с ПОУГ был значимо ниже (15,05 ±2,2 пмоль/л), чем в контрольной группе (20,65±14,5 пмоль/л) (рис. 1).
Как известно, сниженный уровень Т4 является одним из лабораторных проявлений гипотиреоза [12]. Другим признаком гипотиреоза может быть повышение ТТГ, однако значимых различий в уровне ТТГ между группами выявлено не было.
Анализ структуры эндокринологического диагноза пациентов обеих групп показал, что в группе пациентов с ПОУГ чаще, чем в контрольной группе, регистрировался многоузловой зоб (25,35 и 15,79% соответственно) и хронический аутоиммунный тиреоидит (ХАИТ) (11,27 и 6,58% соответственно) (рис. 2).
Поскольку при снижении функции щитовидной железы, как известно из литературы, наблюдается повышение уровня ХС и атерогенных липопротеидов (ЛП), ускоряющих развитие атеросклероза [13], нами был проведен анализ данных уровня ХС, ЛП и ТГЦ в крови пациентов с ПОУГ и группы контроля. Значимых различий выявлено не было, однако в группе пациентов с ПОУГ наблюдалась тенденция к более высокому уровню ХС (ХС выше нормы у 70,4% пациентов, в группе контроля — у 63,2%) и ТГЦ (ТГЦ выше нормы у 12,7% пациентов, в группе контроля — у 7,9%) (рис. 3).
Уровень глюкозы в крови у пациентов с ПОУГ и в контрольной группе значимо не различался, но в группе пациентов с ПОУГ в 3,7 раза чаще регистрировался сахарный диабет 2 типа (9,86 и 2,63% пациентов соответственно) (рис. 2), что свидетельствует о наличии функциональных расстройств не только щитовидной железы, но и других гормональных нарушений. На наш взгляд, исследования в этом направлении целесообразно продолжить.
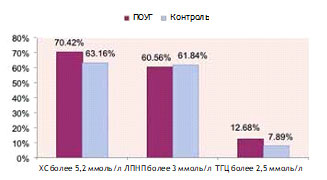
Рис. 2. Структура эндокринологического диагноза в исследуемых группах
Обсуждение
Как уже было отмечено, в литературе представлены противоречивые данные как подтверждающие, так и опровергающие наличие взаимосвязи между заболеваниями щитовидной железы и глаукомой. Вероятная связь гипотиреоза и глаукомы может быть обусловлена отложением мукополисахаридов (гликозаминогликанов) в трабекулярной сети, что приводит к росту сопротивления оттоку водянистой влаги и повышению внутриглазного давления (ВГД), а также к активации аутоимунных механизмов [14].
В подтверждение данной гипотезы в работе K. Smith et al. выявлено, что пациенты с гипотиреозом, получающие заместительную терапию, имеют значительно лучшие показатели оттока внутриглазной жидкости и ВГД [15]. Однако в рамках данной гипотезы отмечаются несогласующиеся данные. Так, особая роль в процессе накопления гликозаминогликанов в трабекулярной сети принадлежит гиалуроновой кислоте. Гипотиреоз сопровождается ее накоплением в тканях, но, как демонстрирует исследование P. Knepper et al. [16], при глаукоме наблюдается снижение содержания гиалуроновой кислоты в трабекулярной сети (77% по сравнению с контрольной группой).
В свою очередь, согласно данным М. Guo et al., гиалуроновая кислота индуцирует синтез ММР-2 и 9, поэтому снижение уровня гиалуроновой кислоты может сопровождаться накоплением компонентов экстрацеллюлярного матрикса [17]. Таким образом, в настоящее время механизмы взаимосвязи гипотиреоза и глаукомы до конца не ясны. Возможно, изменения биохимических свойств и функционального состояния трабекулярной сети при ПОУГ связаны не с гиалуроновой кислотой, а с накоплением других компонентов экстрацеллюлярного матрикса, в частности, вызванным пониженным синтезом ММР-2 и 9.
Среди работ, подтверждающих связь глаукомы и гипотиреоза, следует отметить ретроспективное исследование H. Lin et al., в рамках которого были отобраны пациенты старше 60 лет с гипотиреозом в качестве основного диагноза [5]. На момент манифестации гипотиреоза у этих пациентов глаукома диагностирована не была.
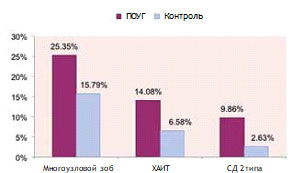
Рис. 3. Процент пациентов с отклонениями биохимических показателей крови от нормы. За норму приняты лабораторные стандарты, используемые в лаборатории Филиала ФБУЗ «Лечебно-реабилитационный центр Минэкономразвития России»
По данным этого исследования, риск развития глаукомы в течение 5 лет у пациентов с гипотиреозом, не получавших лечение левотироксином, был значимо выше (в 1,78 раза), чем в контрольной группе, в то время как при сравнении частоты глаукомы среди группы пациентов с гипотиреозом, принимавших левотироксин, и группы контроля не было выявлено статистически значимой разницы [5].
По данным В.Г. Лихванцевой с соавт., в работе которых были проанализированы данные областного регистра за 5 лет, распространенность глаукомы у пациентов с заболеваниями щитовидной железы была в 2,99 раза выше, чем при их отсутствии [3].
Smith et al. провели исследование по типу «случай-контроль», в рамках которого 64 пациента с ранее установленным диагнозом ПОУГ и 64 пациента группы контроля были обследованы на наличие гипотиреоза. Выявлено, что в группе ПОУГ гипотиреоз подтвердился у 23,4% пациентов: в 12,5% случаев диагноз гипотиреоз был выявлен ранее, а у 10,9% впервые.
В контрольной группе гипотиреоз выявлен лишь у 4,7% пациентов: у 1,6% выявлен ранее, у 3,1% — впервые, различие между группами пациентов с ПОУГ и контрольной статистически достоверно. Авторы обратили внимание на высокий процент недиагностированного гипотиреоза и на необходимость продолжения исследований в данном направлении [6].
Однако другие специалисты не обнаружили статистически значимой связи между гипотиреозом и глаукомой. Так, S. Motsko и J. Jones провели популяционное исследование базы данных общенационального опроса населения, в котором было зарегистрировано 4 728 случаев ПОУГ и 14 184 случая, относящихся к группе контроля (пациенты без ПОУГ).
При проведении многофакторного регрессионного анализа (с учетом других факторов риска: ишемической болезни, цереброваскулярных заболеваний, гиперлипидемии и артериальной гипертонии, сахарного диабета и мигрени) установлено, что ПОУГ в сочетании с гипотиреозом встречается в 17,2% случаев, при этом частота гипотиреоза в группе контроля практически такая же — 17,6% случаев [10].
Представленные данные согласуются с результатами другого кросс-секционного исследования, проведенного C Kakigi et al., в рамках которого были проанализированы показатели двух общенациональных опросов населения: National Health Interview Survey (NHIS ) в 2008 г. и National Health and Nutrition Examination Survey (NHANES ) в 2007 и 2008 гг.
В общей сложности было включено 13 599 человек из NHIS и 3 839 человек из NHANES. Многофакторный регрессионный анализ, проведенный с учетом возраста, пола, расы, не выявил связи между наличием глаукомы и гипотиреоза или других заболеваний щитовидной железы в обоих опросах [7].
Karadimas et al . проведено кросс-секционное исследование, в рамках которого изучали 100 пациентов с впервые выявленным гипотиреозом на предмет наличия глаукомы: проведено офтальмологическое обследование, включающее компьютерную периметрию и обследование диска зрительного нерва. После начала заместительной терапии гипотиреоза проведено повторное офтальмологическое обследование. По полученным данным, ни у одного пациента с гипотиреозом не выявлена глаукома, а также не выявлена связь между уровнем ВГД до и после начала заместительной терапии гипотиреоза [9].
Однако при сопоставлении данных о наличии или отсутствии связи между глаукомой и гипотиреозом необходимо учитывать типы и дизайн исследований. Исследования, подтверждающие обсуждаемую взаимосвязь, в основном проведены на базе специализированных клиник, а исследования, опровергающие такую взаимосвязь, осуществлялись на базе общенациональных специализированных опросов населения. Преимуществом первого типа исследований является достоверная клиническая база, преимуществом второго — значительно большая выборка.
Вместе с тем необходимо иметь в виду, что результаты анкетирования в рамках общенациональных опросов должны интерпретироваться в свете нескольких ограничений. Основываясь только на ответах респондентов, весьма вероятно получить некорректные данные. A. Ryskulova et al. наглядно описали данный феномен в своем исследовании, показав, что результаты, основанные на ответе респондентов о наличии у них глаукомы, оказались значительно заниженными по сравнению с данными медицинских карт.
Действительно, в более ранних исследованиях было показано, что лишь половина заболевших знают о наличии у них глаукомы и только четверть из них получает адекватную терапию [18-25]. С другой стороны, в исследовании T. Brix et al. выявлено, что положительные ответы респондентов о наличии гипои гипертиреоза значительно завышены [26]. Очевидно, в таком типе исследованиях изначально заложена ошибка, так как пациенты с глаукомой ее часто отрицают, а пациенты, утверждающие, что страдают гипоили гипертиреозом, могут на самом деле иметь другую патологию или быть здоровыми, что в конечном счете маскирует взаимосвязь между глаукомой и заболеваниями щитовидной железы и приводит к ее недооценке. Вместе с тем исследования в данном направлении являются важными и необходимыми, учитывая высокую распространённость обоих заболеваний среди населения в целом.
Первопричины ПОУГ остаются до конца неизвестными, но накопление данных о взаимосвязи глаукомы с другими хроническими заболеваниями приводит к новой парадигме ее диагностики и контроля: это заболевание должно рассматриваться не как изолированная патология органа зрения, а как многофакторная система, на развитие и прогрессию которой влияет общий статус организма. Исследования в данном направлении являются перспективными, особенно в случае обнаружения модифицируемых, т. е. управляемых и поддающихся коррекции факторов риска, каким является, в том числе, и гипотиреоз.
Заключение
Проведенное нами исследование показало наличие определенной взаимосвязи между изменениями гормонального профиля щитовидной железы и развитием ПОУГ. Полученные результаты имеют, на наш взгляд, важное значение, так как показывают, что заболевания щитовидной железы, в частности гипотиреоз, могут быть независимым фактором риска развития ПОУГ, что необходимо учитывать при проведении диспансеризации, ранней диагностики и мониторинга этого заболевания.
Литература/References
- Егоров Е.А., Астахов Ю.С., Еричев В.П. Национальное руководство по глаукоме: для практикующих врачей. 3-е изд. испр. и доп. М.: ГЭОТАР-Медиа, 2015; 456 с. [Egorov E.A., Astakhov Yu.S., Erichev V.P. Natsional’noe rukovodstvo po glaukome: dlya praktikuyushchikh vrachei [National guidelines for glaucoma: for practicing doctors]. M.: GEOTAR–Media, 2015. 456 p. (In Russ.)].
- Moyer , LeFevre M.L., Siu A.L. Screening for glaucoma: U.S. Preventive Services Task Force Recommendation Statement. Ann Intern Med 2013; 159(7):484-489. doi: 10.7326/0003-4819159-6-201309170-00686.
- Лихванцева В.Г., Коростелёва Е.В., Табеева К.И., Выгодин В.А. Ассоциативная связь заболеваний щитовидной железы и первичной открытоугольной глаукомы. Глаукома 2013; 2:19-22. [Likhvanceva G., Korosteljova E.V., Tabeeva K.I., Vygodin V.A. Associative connection of thyroid gland diseases and primary open-angle glaucoma. Glaucoma 2013; 2:19-22. (In Russ.)]. doi: 10.17686/sced_rusnauka_2013-428.
- Lee J., Rochtchina E., Healey P.R. et al. Open-angle glaucoma and systemic thyroid disease in an older population: The Blue Mountains Eye Study. Eye 2004; 18:600-608. doi: 10.1038/sj.eye.670073.
- Lin C., Kang J.H., Jiang Y.D., Ho J.D. Hypothyroidism and the risk of developing open-angle glaucoma. Ophthalmology 2010; 117(10):1960-1966. doi: 10.1016/j.ophtha.2010.02.005.
- Cross M., Girkin С.А., Owsley С., McGwin Jr. The association between thyroid problems and glaucoma. PLoS One 2015; 10(7): e0133688 doi: 10.1136/bjo.2008.147165.
- Smith D., Arthurs B.P., Saheb N. An association between hypothyroidism and primary open-angle glaucoma. Ophthalmology 1993; 100:1580-1584.
- Лихванцева В.Г., Коростелева Е.В., Ковеленова И.В., Буданова С.В., Бен Режеб Амин. Дефицит глазного кровотока — ключевой фактор, определяющий форму вторичной глаукомы при эндокринной офтальмопатии. РОЖ 2016; 9(3):43-49. [Likhvantseva V.G., Korosteleva E.V., Kovelenova I.V., Budanov S.V., Ben Rezh Amin. Deficiency of eye blood flow as a key factor determining the form of secondary glaucoma in endocrine Russian Ophthalmological Journal 2016; 9(3):43-49. (In Russ.)]. doi: 10.1016/0014-4835(92)90793-r.
- Kakigi С., Kasuga , Wang S., Singh K., Hiratsuka Y., Murakami A. Hypothyroidism and Glaucoma in The United States. PLoSOne 2015; 10(7):e0133688. doi: 10.1371/journal.pone.0133688.
- Karadimas , Bouzas E.A., Topouzis F. et al. Hypothyroidism and glaucoma. A study of 100 hypothyroid patients. Am J Ophthalmol 2001; 131:126–128. doi: 10.1016/s0002-9394(00)00724-8.
- Motsko S.P., Jones J.K. Is there an association between hypothyroidism and open-angle glaucoma in an elderly population? An epidemiologic Ophthalmology 2008; 115(9):1581-1584. doi: 10.1016/j.ophtha.2008.01.016.
- Петунина Н.А., Трухина Л.В. Гипотиреоз. РМЖ 2013; 12:664-667. [Petunina A., Trukhina L.V. Hypothyroidism. Russian Medical Journal 2013; 12:664-667. (In Russ.)].
- Shin J., Osborne T.F. Thyroid hormone regulation and cholesterol metabolism are connected through Sterol Regulatory Element – Binding Protein (SREBP-2). J Biol Chem 2003; 278:34114-34118. doi:10.1074/jbc.m305417200.
- Duncan G., Jumper M.D., Ribeiro R.C. et al. Human trabecular meshwork cells as a thyroid hormone target tissue: presence of functional thyroid hormone receptors. Graefes Arch Clin Exp Ophthalmol 1999; 237:231-240. doi: 10.1007/s004170050224.
- Smith D., Tevaarwerk G.J., Allen L.H. An ocular dynamic study supporting the hypothesis that hypothyroidism is a treatable cause of secondary open-angle glaucoma. Can J Ophthalmol 1992; 27:341-344.
- Knepper A. Surface-tension properties of hyaluronic acid. J Glaucoma 1995; 4:194-199.
- Guo W.Y. Hyaluronic acid increases MMP-2 and MMP-9 expressions in cultured trabecular meshwork cells from patients with primary open-angle glaucoma. Molecular Vision 2012; 18:1175-1181.
- Ryskulova , Turczyn K., Makuc D.M., Cotch M.F., Klein R.J., Janiszewski R. Self-reported age-related eye diseases and visual impairment in the United States: results of the 2002 National Health Interview Study. Am J Pub Health 2008; 98:454-461. doi: 10.2105/AJPH.2006.098202.
- Манцева Я.Ю., Астахов С.Ю., Ананьевская П.В., Титаренко А.И. Влияние факоэмульсификации на уровень внутриглазного давления у больных с сочетанием катаракты и открытоугольной глаукомы. Офтальмологические ведомости 2013; 6(1):29-34. [Mantseva Yu., Astakhov S.Yu., Anan’evskaya P.V.,Titarenko A.I. Influence of phacoemulsification on the level of intraocular pressure in patients with a combination of open-angle glaucoma and cataracts. Ophthalmologic vedomosti 2013; 6(1): 29-34. (In Russ.)].
- Еричев В.П., Петров С.Ю., Макарова А.С., Козлова И.В. и др. Современные методы функциональной диагностики и мониторинга глаукомы. Часть 2. Диагностика структурных повреждений сетчатки и зрительного нерва. Национальный журнал глаукома 2015; 14(3):72-79. [Erichev V.P., Petrov S.Yu., Kozlova I.V., Makarova A.S. et al. Modern methods of functional diagnostics and monitoring of Part 1. Diagnosis of structural damage of the retina and optic nerve. Natsional’nyi zhurnal glaukoma 2015; 14(3):72-79. (In Russ.)].
- Мамиконян В.Р., Галоян Н.С., Шеремет Н.Л., Казарян Э.Э., Харлап С.И., Шмелева-Демир О.А., Анджелова Д.В., Татевосян А.А. Особенности глазного кровотока при ишемической оптической нейропатии и нормотензивной глаукоме. Вестник офтальмологии 2013; 129(4):3-9. [Mamikonian R., Galoian N.S., Sheremet N.L., Kazarian , Kharlap S.I., Shmeleva-Demir O.A., Andzhelova D.V., Tatevosian A.A. Peculiarities of ocular blood flow in ischemic optic neuropathy and normal tension glaucoma. Vestn Oftalmol 2013; 129(4):3-9. (In Russ.)].
- Астахов Ю.С., Акопов Е.Л., Нефедова Д.М. Сосудистые факторы риска развития первичной открытоугольной глаукомы. РМЖ Клиническая офтальмология 2008; 2:68-70. [Astakhov S., Akopov E.L., Nefedova D.M. Vascular risk factors of primary openangle glaucoma development. RMJ Clinical Ophthalmology 2008; 2:68-70. (In Russ.)].
- Мамиконян В.Р., Юсеф Наим Юсеф, Введенский А.С., Саид Наим Юсеф, Казарян Э.Э., Галоян Н.С., Татевосян А.А. Результаты комбинированного хирургического лечения открытоугольной глаукомы и катаракты. Вестник офтальмологии 2010; 126(4):3-6. [Mamikonyan R., Yusef Naim Yusef, Vvedensky A.S., Said Naim Yusef, Kazaryan E.E., Galoyan N.S., Tatevosyan A.A. Results of combination surgical treatment for open-angle glaucoma and cataract. Vestn Oftalmol 2010; 126(4): 3-6. (In Russ.)].
- Еричев В.П., Козлова И.В., Акопян А.И., Макарова А.С. и др. Селективные симпатомиметики в монои комбинированной терапии глаукомы. Национальный журнал глаукома 2015; 14(1):44-51. [Erichev V.P., Kozlova I.V., Akopyan A.I., Makarova A.S. et al. Selective sympathomimetics in monoand combination glaucoma therapy. Natsional’nyi zhurnal glaukoma 2015; 14(1):44-51. (In )].
- Астахов С.Ю., Грабовецкий В.Р., Нефедова Д.М., Ткаченко Н.В. Преимущества и недостатки гипотензивных капель без консерванта. Офтальмологические ведомости 2011; 4(2):95-98. [Astakhov S.Yu., Grabovetskii V.R., Nefedova M., Tkachenko N.V. Advantages and disadvantages of preservativefree antihypertensive eyedrops. Ophthalmologic vedomosti 2011; 4(2):95-98. (In Russ.)].
- Brix H., Kyvik K.O., Heged s. Validity of self-reported hyperthyroidism and hypothyroidism: comparison of self-reported questionnaire data with medical record review. Thyroid 2001; 11:769-73. doi: 10.1089/10507250152484619.

